题目内容
【题目】下列四种鉴别碳酸钠和碳酸氢钠的方法是否可行?按要求回答下列问题。
(1)将两种试样分别溶于水配成浓度相同的溶液,分别滴入数滴酚酞是否可以鉴别____(可行,不可行),若可行请写出实验现象及结论__。
(2)将两个固体配制成为稀溶液,滴加氯化钙是否可以鉴别___(可行,不可行),若可行请写出实验现象及结论(用离子方程式并结合文字说明)___。
(3)2支试管中分别放入约1g 的两种试样并配成10毫升溶液,同时滴加等量的稀盐酸是否可以鉴别___(可行,不可行),若可行请写出实验现象及结论___。
(4)2支试管中分别放入约1g 的两种试样并配成10毫升溶液,分别滴加足量的氢氧化钙溶液是否可以鉴别___(可行,不可行),原因(用文字说明)___。
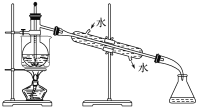
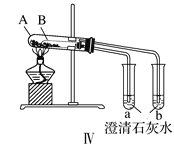
(5)取等质量两种固体,利用如图装置进行鉴别,试管A中装入的固体是___(填化学式),试管B中装入的固体是___(填化学式)。
【答案】可行 溶液的红色较深的是Na2CO3,较浅的为NaHCO3 可行 Ca2++CO32- =CaCO3↓,产生白色沉淀的是Na2CO3,无明显现象的是NaHCO3 可行 立即产生气泡的是NaHCO3,刚开始没有明显现象,后产生气泡的是Na2CO3 不可行 都产生白色沉淀 Na2CO3 NaHCO3
【解析】
根据碳酸钠与碳酸氢钠性质的不同,进行实验探究,并进行评价。
(1)将两种试样分别溶于水配成浓度相同的溶液,两种溶液溶质均水解显碱性,等浓度时碳酸钠水解程度大,利用酚酞鉴别的方案可行,现象为溶液的红色较深的是Na2CO3,较浅的为NaHCO3,故答案为:可行,溶液的红色较深的是Na2CO3,较浅的为NaHCO3;
(2)将两个固体配制成为稀溶液,滴加氯化钙后,碳酸钠会与氯化钙反应生成碳酸钙白色沉淀,而碳酸氢钠则不发生反应,故此方案可行,发生反应的离子方程式为Ca2++CO32- =CaCO3↓,现象为产生白色沉淀的是Na2CO3,无明显现象的是NaHCO3,故答案为:可行;Ca2++CO32- =CaCO3↓,产生白色沉淀的是Na2CO3,无明显现象的是NaHCO3;
(3)因碳酸钠与盐酸反应分步进行,第一步不产生气体,所以2支试管中分别放入约1g 的两种试样并配成10毫升溶液后,再同时滴加等量的稀盐酸,通过观察气体产生的速率,可鉴别二者,此方案可行,现象是:立即产生气泡的是NaHCO3,刚开始没有明显现象,后产生气泡的是Na2CO3;
(4)2支试管中分别放入约1g 的两种试样并配成10毫升溶液,分别滴加足量的氢氧化钙均会产生白色沉淀,因此无法鉴别两者,此方案不可行,原因是:两个试管中都产生白色沉淀,故答案为:不可行;都会产生白色沉淀;
(5)受热温度:A>B,碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定,故试管A中装入的固体是Na2CO3,试管B中装入的固体是NaHCO3,故答案为:Na2CO3;NaHCO3;

 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案