题目内容
【题目】室温下向1L pH=2的醋酸溶液中加入2L pH=2的盐酸,则混合溶液的pH约为(假设混合后溶液体积不变,室温下醋酸的电离平衡常数为1.8×10-5)
A. 2 B. 1.7 C. 2.3 D. 无法确定
【答案】A
【解析】
根据醋酸溶液的pH=2,可知溶液中的c(H+)和c(CH3COO-),结合醋酸的电离平衡常数可求出c(CH3COOH);加入2L pH=2的盐酸时,溶液体积变为3L,计算出混合后溶液中c(H+)、c(CH3COO-)和c(CH3COOH)的浓度,求出浓度商Qc= Ka,判断处于平衡状态,即可确定混合溶液中的c(H+),从而求出pH。
1L pH=2的醋酸溶液中,醋酸电离出的c(H+)= c(CH3COO-)=10-2mol/L,
由于醋酸的电离平衡常数为1.8×10-5,则c(CH3COOH)=![]() =
=![]() mol/L=
mol/L=![]() mol/L;
mol/L;
加入2L pH=2的盐酸时,溶液体积变为3L,则c(CH3COO-)=![]() mol/L、c(H+)=10-2mol/L 、c(CH3COOH)=
mol/L、c(H+)=10-2mol/L 、c(CH3COOH)=![]() mol/L
mol/L![]() =
=![]() mol/L,则Qc=
mol/L,则Qc=![]() =
=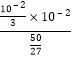 =1.8×10-5=Ka,处于平衡状态,不发生移动,此时溶液中的c(H+)=10-2mol/L,故pH=-lgc(H+)=-lg10-2=2。
=1.8×10-5=Ka,处于平衡状态,不发生移动,此时溶液中的c(H+)=10-2mol/L,故pH=-lgc(H+)=-lg10-2=2。
由以上分析知A项正确。
综上所述,本题正确答案为A。

练习册系列答案
相关题目



