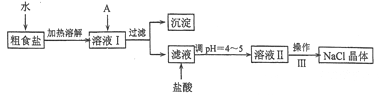
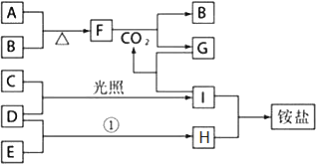
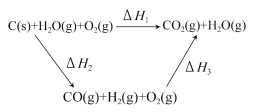
��Ŀ����
����Ŀ��������KMnO4��Һ��H2C2O4��Һ��Ӧ��̽��Ӱ�컯ѧ��Ӧ���ʵ����أ�
��.ʵ��ǰ��������KMnO4����Һ�ζ�δ֪Ũ�ȵIJ���
��Ӧԭ����![]() MnO
MnO![]() ��
��![]() H2C2O4��
H2C2O4��![]() �D��
�D��![]() Mn2����
Mn2����![]() CO2����
CO2����![]() H2O
H2O
(1)��ƽ�������ӷ���ʽ��______
(2)�ζ�ʱKMnO4��ҺӦʢװ��__________(���ʽ����ʽ��)�ζ����С�
��.̽��Ӱ�컯ѧ��Ӧ���ʵ�����
ʵ�� ��� | H2C2O4��Һ | ����KMnO4��Һ | �¶� | ||
Ũ��/mol��L��1 | ���/mL | Ũ��/mol��L��1 | ���/mL | ||
�� | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________(���ţ���ͬ)��
(2)̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________��
��.���ij��ʵ��(����)ʱ��Һ��Mn2�����ʵ�����ʱ���ϵ��ͼ��ʾ������͡�n(Mn2��)�ڷ�Ӧ��ʼʱ�仯����һ��ʱ����������ԭ��________________________��
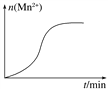
���𰸡� 2��5�� 6H����2��10��8 ��ʽ �ں͢� �ٺ͢� Mn2���Ը÷�Ӧ�д�����
����������.ʵ��ǰ��������KMnO4����Һ�ζ�δ֪Ũ�ȵIJ��ᣬMnԪ�ش�+7�۽��͵�+2�ۣ��õ�5�����ӣ�������CԪ�ش�+3�����ߵ�+4�ۣ���ʧȥ2�����ӣ������������ӵ�ϵ����2�������ϵ����5������Ԫ���غ���ƽMn2����CO2��ϵ��������ɵ���غ���ƽ�����ӡ�ˮ��ϵ������ƽ�õķ���ʽΪΪ��2MnO4��+5H2C2O4+6H��=2Mn2��+10CO2��+8H2O��(2)�ζ�ʱKMnO4��Һ��������ǿ����ʴ��ʽ�ζ��ܵ��齺�ܣ������ü�ʽ�ζ��ܣ�Ҫ����ʽ�ζ���ʢ�Ÿ�����ء�II����1��̽���¶ȶԷ�Ӧ���ʵ�Ӱ��ʱ�������¶Ȳ�ͬ���⣬��������������ȫ��ͬ����ѡ�ںۣ͢�(2)̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ��ʱ����Ӧ�¶ȡ���Һ���������ͬ����ѡ�ٺ͢ڣ���.���ij��ʵ��(����)ʱ��Һ��Mn2�����ʵ�����ʱ���ϵ��ͼ��ʾ������2MnO4��+5H2C2O4+6H��=2Mn2��+10CO2��+8H2O��֪����ʼʱ������Ũ��������������������������������ӶԸ÷�Ӧ���˴����ã����ӿ��˷�Ӧ���ʣ��ʡ�n��Mn2�����ڷ�Ӧ��ʼʱ�仯����һ��ʱ��������������Mn2���Ը÷�Ӧ�д����á�