题目内容
【题目】下列为元素周期表中的一部分:
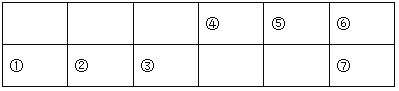
已知:⑤的氢化物常温下为气体,该气体可使湿润的红色石蕊试纸变蓝。
用化学式或元素符号回答下列问题:
(1) ④在周期表中的位置_______。
(2) ①②③中,最高价氧化物对应的水化物碱性最强的物质的电子式为_________。
(3) ①②⑥的简单离子半径由大到小的顺序是___________。(填离子符号)
(4) 用一个化学方程式证明Cl元素与⑦非金属性的强弱:____________。
(5) ①和⑥形成的一种化合物A中含有一种10电子微粒和一种18电子微粒,则A中含有的化学键类型为______。
(6) ⑥、⑦分别形成的氢化物沸点高的是_______(填化学式)。原因是_______。
(7) ①、③分别形成的最高价氧化物对应的水化物相互反应的离子方程式为_________。
【答案】 第二周期 第IVA族 ![]() O2->Na+> Mg2+ Cl2+H2S=S↓+2HCl(合理即可) 共价键和离子键 H2O H2O分子间存在氢键,氢键比分子间作用力强 OH-+Al(OH)3=AlO2-+2H2O
O2->Na+> Mg2+ Cl2+H2S=S↓+2HCl(合理即可) 共价键和离子键 H2O H2O分子间存在氢键,氢键比分子间作用力强 OH-+Al(OH)3=AlO2-+2H2O
【解析】本题分析:本题主要考查元素的性质。
⑤的氢化物常温下为气体,该气体可使湿润的红色石蕊试纸变蓝,该气体是氨,⑤是N。相应地①、②、③、④、⑥、⑦分别是Na、Mg、Al、C、O、S。
(1) ④在周期表中的位置:第二周期 、IVA。
(2) 金属性①>②>③中,最高价氧化物对应的水化物碱性最强的物质是氢氧化钠,其电子式为![]() 。
。
(3) ①②⑥的简单离子电子层结构与氖原子相同,离子半径随着核电荷数增大而减小,离子半径由大到小的顺序是O2->Na+> Mg2+。
(4) 用一个化学方程式证明Cl元素与⑦非金属性的强弱:Cl2+H2S=S↓+2HCl(合理即可)。
(5) A是过氧化钠,钠离子与过氧根之间存在离子键,过氧根内含有共价键,所以A中含有的化学键类型为共价键和离子键。
(6) ⑥、⑦分别形成的氢化物是水和硫化氢,沸点高的是H2O。原因是H2O分子间存在氢键,氢键比分子间作用力强。
(7) ①、③分别形成的最高价氧化物对应的水化物是氢氧化铝和氢氧化钠,相互反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O。

 步步高达标卷系列答案
步步高达标卷系列答案