��Ŀ����
����Ŀ����ʽ̼��ͭ[Cu2(OH)2CO3]��һ����;�㷺�Ļ���ԭ�ϣ�ʵ�����Է�ͭмΪԭ����ȡ��ʽ̼��ͭ�IJ������£�
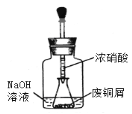
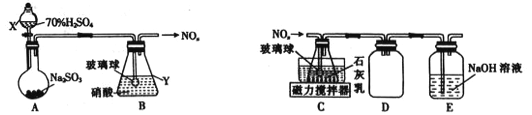
����һ����ͭм������ͭ
��ͼ���ý�ͷ�ι���ȡŨHNO3�����ӵ���ƿ�ڵķ�ͭм��(��ͭм����)����ַ�Ӧ����ˣ��õ�����ͭ��Һ��
���������ʽ̼��ͭ���Ʊ�
����Թ��м���̼������Һ������ͭ��Һ��ˮԡ������70�����ң���0.400 mol��L��1��NaOH��Һ����pH��8.5�������ã����ˣ�����ˮϴ�ӣ���ɣ��õ���ʽ̼��ͭ��Ʒ����ش�
��1��ͭ��Ũ���ᷴӦ�����ӷ���ʽ ��
��2����ͼװ����NaOH��Һ�������� ��
��3���������ϴ�ӵ�Ŀ���� ��
��4����ʵ��õ�2.42 g��Ʒ(ֻ��CuO����)��ȡ����Ʒ�������ֽ���ȫ�õ�1.80 g���壬����Ʒ�м�ʽ̼��ͭ������������ ��
���𰸡���1��Cu+4H++2NO3=Cu2++2NO2��+2H2O��
��2�����յ�����������ֹ��Ⱦ������
��3����ȥ��Ʒ���������(NaNO3)����4��91.7%��
��������
�����������1��ͭ��Ũ���ᷴӦ��������ͭ��NO2��H2O�����ӷ�Ӧ����ʽΪ��Cu��4H����2NO3��=Cu2����2NO2����2H2O��(2)����NOx�ж����Ի�������Ⱦ����˱����ȥ���������������������յ��������ֹ��Ⱦ������(3)���˺�Ʒ���溬��NaNO3��NaNO3�Բ�Ʒ�����������IJⶨ������Ӱ�죬�����ȥ��ϴ�ӵ�Ŀ���dz�ȥ��Ʒ��������ʣ�
(4)Cu2(OH)2CO3=2CuO��CO2����H2O ��m
222 62
m(Cu2(OH)2CO3) 2.42-1.8
���m(Cu2(OH)2CO3)=2.22g����������Ϊ2.22/2.42��100%=91.7%��

����Ŀ��X��Y��Z��M��Q��R��6�ֶ�����Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ����£�
Ԫ�ش��� | X | Y | Z | M | Q | R |
ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
��Ҫ���ϼ� | ��2 | ��3 | ��6����2 | ��5����3 | ��4����4 | ��1 |
��1��Z��Ԫ�����ڱ��е�λ����___________________________________________��
��2��Ԫ��Q��R�γɵĻ�����A�ǹ�ʵ���������A�Ʊ��Ҵ��Ļ�ѧ����ʽ��_________��
��3������ͭ��Ԫ��M������������Ӧˮ�����ϡ��Һ������Ӧ�����ӷ���ʽΪ______________________________________________________________________��
��4��Ԫ��X�Ľ����Ա�Ԫ��Y___���ǿ��������������ԭ�ӽṹ��֪ʶ����ԭ��___________��
��5��Ԫ��Q��Ԫ��Z�ĺ���Ӱ��������ܣ�������ͼװ��A�ڸ����½�������Ԫ��Q��Ԫ��Zת��ΪQO2��ZO2��

������a�ijɷ���________________���ѧʽ����
����������Ԫ��Z��FeZ����ʽ���ڣ���A�з�Ӧ����ZO2���ȶ��ĺ�ɫ�������Ӧ�Ļ�ѧ����ʽ��_______________________________________________________��