题目内容
下列说法中正确的是( )
A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
B.AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
D.硬水中含有较多的Ca2+、Mg2+、HCO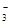 、SO
、SO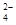 ,加热煮沸可以完全除去其中的Ca2+、Mg2+
,加热煮沸可以完全除去其中的Ca2+、Mg2+
【答案】
C
【解析】A项中温度升高,Ca(OH)2溶解度降低,氢氧根离子浓度减小,碱性减弱,pH减小,A项错误;B项中加入NaCl,虽然平衡左移,但加入了NaCl粉末会使溶液中离子的总浓度会增大,B项错误;沉淀总是向溶解度更小的方向转化,C项中现象说明AgI的溶解度小于AgCl,对于同类型(阴、阳离子个数分别相等)的难溶物,Ksp越小,溶解度越小,C项正确;D项加热煮沸,只能降低Ca2+、Mg2+的浓度,而不可能完全除去,D项错误。
考点:难容电解质溶解平衡的应用
点评:注意影响溶解平衡的因素,温度升高,一般有利于溶解,但要注意有些特例,如本题中的氢氧化钙就是这种特例,温度越高,溶解度反而更低。

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
下列说法中正确的是( )
| A、进行钠的有关性质实验时,用剩的钠应放回原试剂瓶 | B、常用25.00 ml 碱式滴定管准确量取20.00 ml KMnO4溶液 | C、用湿润的淀粉碘化钾试纸可以鉴别NO2和Br2蒸气 | D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
| A、两种物质的阴离子半径都比阳离子半径小 | B、溶于水,所得溶液都能使无色酚酞变红 | C、与水反应时,水都做氧化剂 | D、与盐酸反应都只生成一种盐 |
下列说法中正确的是( )
| A、用碱石灰除去氯气中的水 | B、碘化银是重要的感光材料,溴化银可用于人工降雨 | C、过氧化钠可用作潜艇里氧气的来源 | D、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
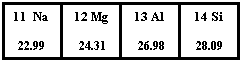 如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )
如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )| A、Si元素的名称是硅,其核电荷数为14 | B、Mg原子的结构示意图是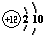 | C、Al的相对原子质量是26.98g | D、它们都属于金属元素 |
下列说法中正确的是( )
| A、O、Na、S元素的原子半径依次增大 | B、KOH、Mg(OH)2、Ba(OH)2的碱性依次增强 | C、H2SO4、H3PO4、HClO4的酸性依次增强 | D、F2、Cl2、Br2、I2的氧化性依次减弱 |