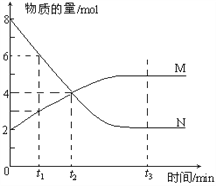
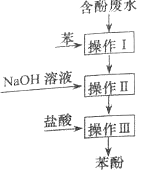
题目内容
【题目】【河北省邢台市第二中学2017届高三上学期第三次月考】下述实验不能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 将 | 制备 |
B | 向沸水中滴加几滴 | 制备 |
C | 向某溶液中加入稀 | 检验溶液中是否含有 |
D | 相同温度下,测定浓度分别为0.1mol·L-1的 | 比较 |
【答案】C
【解析】A.铝离子水解生成的盐酸为挥发性酸,则将AlCl3溶液蒸干灼烧得到氧化铝,故A正确;B.向沸水中滴加几滴FeCl3饱和溶液,继续加热至红褐色,铁离子水解生成胶体,故B正确;C.向某溶液中加入稀H2SO4,将产生的气体通入澄清石灰水,气体为二氧化碳或二氧化硫,则原溶液中可能含碳酸根离子、碳酸氢根离子或亚硫酸根离子等,故C错误;D.盐中弱酸根离子对应的酸越弱,水解程度越大,则相同温度下,测定浓度分别为0.1mol/L的Na2CO3和CH3COONa溶液的pH可比较酸的强弱,故D正确;故选C。
【名师点评】:对于盐溶液的蒸干产物总结如下:(1)金属阳离子易水解的易挥发性酸盐得金属氢氧化物。例如氯化铝得氧化铝,氯化铁得氧化铁;而硫酸铝的蒸干还是硫酸铝;(2)酸根阴离子易水解的强碱盐,正盐是元物质,酸式盐考虑水解产物或分解,例如碳酸钠蒸干是碳酸钠,碳酸氢钠蒸干分解得碳酸钠;(3)易氧化的蒸干得氧化产物,如硫酸亚铁得硫酸铁,亚硫酸钠得硫酸钠。

【题目】碱性锌锰电池是日常生活中消耗量最大的电池, 其构造如图所示。放电时总反应为:Zn + 2H2O + 2MnO2==Zn(OH)2 + 2MnOOH 从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
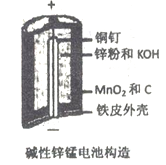
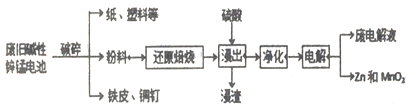
回答下列问题:
(1)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),碳作为还原剂生成CO2,则CO2的电子式为___________。
(2)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。己知浸出液中Mn2+、Zn2+的浓度约为0.1mol·L-1,根据下列数据计算,调节pH的合理范围是____至_______。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(离子浓度小于1×10-5 mol·L-1即为沉淀完全)
(3)“电解”时,阳极的电极反应式为______________。
本工艺中应循环利用的物质是____________(填化学式)。
(4)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为___________________。
(5)某碱性锌锰电池维持电流强度0.5A (相当于毎秒通过5×10-6mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
【题目】某同学设计计如下图所示装罝(部分夹持装置己略去)进行实验探究:
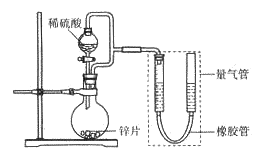
(1)用上述装置探究影响化学反应速率的因素。以生成9.0 mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | C(H2SO4)/mol·L-1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
①比较实验I和Ⅱ可以得出的实验结论是_______________。
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是_________(填序号)。
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用________(填序号)。
A.稀HCl B .NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_____________。