题目内容
【题目】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示. 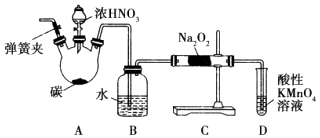
已知:室温下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO2﹣都能与MnO4﹣反应生成NO3﹣和Mn2+ .
请按要求回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间气体X,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡.则X为 , 上述操作的作用是 .
(2)B中观察到的主要现象是 .
(3)A中盛装浓HNO3的仪器名称为 , A装置中反应的化学方程式为 .
(4)D装置中反应的离子方程式为 .
(5)预测C中反应开始阶段,产物除NaNO2外,还含有的副产物有Na2CO3和 . 为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为 .
(6)利用改进后的装置,将3.12g Na2O2完全转化成为NaNO2 , 理论上至少需要木炭g.
【答案】
(1)氮气(或稀有气体);排尽空气,防止生成的NO被O2氧化
(2)红棕色气体消失,铜片溶解,溶液变蓝,导管口有无色气泡冒出
(3)分液漏斗;C+4HNO3 ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(4)3MnO4﹣+5NO+4H+═3Mn2++5NO3﹣+2H2O
(5)NaOH;碱石灰
(6)0.48
【解析】解:(1.)生成的NO被O2氧化,故为防止NO被氧化,实验开始前通入一段时间气体氮气,排尽空气; 所以答案是:氮气(或稀有气体);排尽空气,防止生成的NO被O2氧化;
(2.)二氧化氮在B中与水反应是硝酸,硝酸与Cu反应生成硝酸铜与NO,观察到的现象为:红棕色气体消失,铜片溶解,溶液变蓝,导管口有无色气泡冒出;
所以答案是:红棕色气体消失,铜片溶解,溶液变蓝,导管口有无色气泡冒出;
(3.)由仪器构造可知A中盛装浓HNO3的仪器为分液漏斗;C与HNO3(浓)反应生成二氧化碳与二氧化氮,反应方程式为:C+4HNO3 ![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
所以答案是:分液漏斗;C+4HNO3 ![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(4.)由题目信息,酸性条件下,NO能与MnO4﹣反应生成NO3﹣和Mn2+ , 反应离子方程式为:3MnO4﹣+5NO+4H+=3Mn2++5NO3﹣+2H2O;
所以答案是:3MnO4﹣+5NO+4H+═3Mn2++5NO3﹣+2H2O;
(5.)二氧化碳、水蒸气与过氧化钠反应的得到碳酸钠、氢氧化钠,可以在B、C之间添加成分碱石灰的装置,吸收除去二氧化碳,并干燥NO气体;
所以答案是:NaOH;碱石灰;
(6.)n(Na2O2)= ![]() =0.04mol,根据2NO+Na2O2=2NaNO2知,0.04mol过氧化钠反应需要0.08molNO,设参加反应的碳为 nmol,根据C+4HNO3(浓)
=0.04mol,根据2NO+Na2O2=2NaNO2知,0.04mol过氧化钠反应需要0.08molNO,设参加反应的碳为 nmol,根据C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O知,生成4nmolNO2 , 根据3NO2+H2O=2HNO3+NO,可知4nmolNO2与水反应生成4nmol×
CO2↑+4NO2↑+2H2O知,生成4nmolNO2 , 根据3NO2+H2O=2HNO3+NO,可知4nmolNO2与水反应生成4nmol× ![]() =
= ![]() nmol硝酸和
nmol硝酸和 ![]() nmolNO,再根据3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,硝酸与铜反应生成的NO为
nmolNO,再根据3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,硝酸与铜反应生成的NO为 ![]() nmol×
nmol× ![]() =
= ![]() nmol,所以
nmol,所以 ![]() nmol+
nmol+ ![]() nmol=2nmol=0.08mol,可得n=0.04mol,则需要碳的质量=12g/mol×0.04mol=0.48g;
nmol=2nmol=0.08mol,可得n=0.04mol,则需要碳的质量=12g/mol×0.04mol=0.48g;
所以答案是:0.48g.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】如表是甲同学研究氯水性质实验片段的活动记录.
实验内容 | 实验现象 | 解释及结论 |
观察氯水的颜色、状态 | 呈黄绿色 | ① |
向氯水中滴入几滴硝酸银溶液 | 有白色沉淀 | ② |
用玻璃棒蘸取氯水,点在蓝色石蕊试纸上 | 滴有氯水的试纸中间变白,外圈变红 | ③ |
(1)根据上述实验内容和现象,选择合理解释填到表中(填序号)A.氯化中存在Cl﹣
B.氯水中有漂白性物质和酸性物质
C.氯水中存在Cl2分子
(2)甲同学在实验中运用了进行探究(填序号)
A.观察法
B.比较法
C.分类法
D.实验法
(3)乙同学在甲同学的实验基础上设计了如图实验装置进一步研究氯气的性质.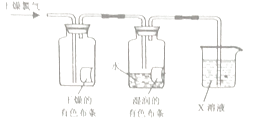
回答下列问题:
①实验中,乙同学观察到干燥的有色布条不褪色,湿润的有色布条褪色,得出的实验结论是 .
②为了防止多余的氯气污染空气,实验室常用X溶液来吸收尾气,写出X的化学式 .