题目内容
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
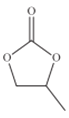
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。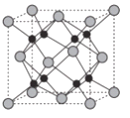
【答案】 p 5s25p4 6 球形 O>Cl>C 平面三角形 sp2、sp3 l3NA(或13×6.02×1023) H2O BC 8 ![]()
【解析】(1)Te与O是同一主族元素,属于元素周期表中p区元素,Te为第5周期第ⅥA族元素,其基态原子的价电子排布式为5s25p4,故答案为:p;5s25p4;
(2)基态Na原子的电子排布式为1s22s22p63s1,核外电子占据的原子轨道总数为6,最高能层电子为3s,电子云轮廓图为球形,故答案为:6;球形;
(3)元素的非金属性越强,氧气与氯化氢能够反应生成氯气和水,氧元素的非金属性最强,电负性数值越大,C、O、Cl的电负性由大到小的顺序为O>Cl>C,故答案为:O>Cl>C;
(4)CO32-中C的价层电子对数=3+![]() ×(4+2-3×2)=3,几何构型为平面三角形;根据碳酸丙烯酯的结构简式,则其中碳原子有2种,不饱和的碳氧双键中的C原子采用sp2杂化,饱和的碳原子采用sp3杂化;1mol碳酸丙烯酯中含有6molC-H,4molC-O,2molC-C和1molC=O,共13mol,键的数目为13×6.02×1023,故答案为:平面三角形;sp2、sp3;13×6.02×1023;
×(4+2-3×2)=3,几何构型为平面三角形;根据碳酸丙烯酯的结构简式,则其中碳原子有2种,不饱和的碳氧双键中的C原子采用sp2杂化,饱和的碳原子采用sp3杂化;1mol碳酸丙烯酯中含有6molC-H,4molC-O,2molC-C和1molC=O,共13mol,键的数目为13×6.02×1023,故答案为:平面三角形;sp2、sp3;13×6.02×1023;
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是H2O,该配离子包含的作用力有H-O极性键、配位键,故答案为:BC;
(6)晶胞中Na+离子数目为8,O2-离子数目为8×![]() +6×
+6×![]() =4,Na+离子、O2-离子数目之比为2:1,故该晶体化学式为Na2O,由图可知,每个Na+离子周围有4个O2-离子,Na+离子配位数为4,距一个阴离子周围最近的所有阳离子有8个,则O的配位数为8;晶胞质量为
=4,Na+离子、O2-离子数目之比为2:1,故该晶体化学式为Na2O,由图可知,每个Na+离子周围有4个O2-离子,Na+离子配位数为4,距一个阴离子周围最近的所有阳离子有8个,则O的配位数为8;晶胞质量为![]() g,该晶胞的密度为ρgcm-3,而晶胞体积为
g,该晶胞的密度为ρgcm-3,而晶胞体积为![]() g÷ρgcm-3=
g÷ρgcm-3=![]() cm3,晶胞棱长为
cm3,晶胞棱长为 cm,则Na与O之间的最短距离为立方体对角线的
cm,则Na与O之间的最短距离为立方体对角线的![]() =
=![]() ×
×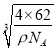 cm,故答案为:8;
cm,故答案为:8; ![]() ×
× 。
。

【题目】1 mol 苯乙烯(![]() )在不同条件下与H2发生加成反应时,产物存在差异:
)在不同条件下与H2发生加成反应时,产物存在差异:
条件 | 消耗氢气 | 加成产物 | |
① | 室温、低压、催化剂 | 1 mol |
|
② | 高温、高压、催化剂 | 4 mol |
|
下列说法正确的是
A.两种条件下的加成产物都属于芳香烃
B.两种条件下的加成产物都能使酸性高锰酸钾溶液褪色
C.两种条件下的加成产物都能在光照条件下与溴进行取代
D.该现象说明侧链上的碳碳双键比苯环内的碳碳双键更活泼