题目内容
【题目】芘经氧化后可进一步用于染料合成。芘的一种转化路线如图:
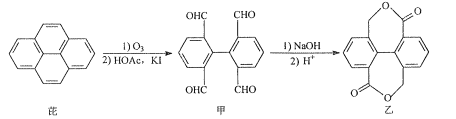
下列叙述正确的是( )
A.芘的分子式为C16H10
B.甲分子中所有碳原子一定都在同平面上
C.甲在一定条件下可发生加成反应和银镜反应
D.1mol乙与足量NaOH溶液反应,最多消耗4molNaOH
【答案】AC
【解析】
A.根据结构,可以判断芘的分子式为C16H10,A选项正确;
B.甲分子的两个苯环相连的单键可以旋转,因此不一定都在同一平面上,B选项错误;
C.甲分子中含有苯环和醛基,苯环可以发生加成反应,醛基可发生银镜反应,C选项正确;
D.乙分子能与NaOH发生反应的官能团为羧基,且1mol羧基只与1molNaOH反应,1mol乙分子中含有2mol羧基,则最多消耗2molNaOH,D选项错误;
答案选AC。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
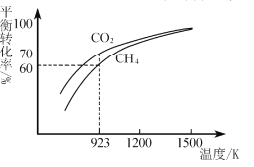
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
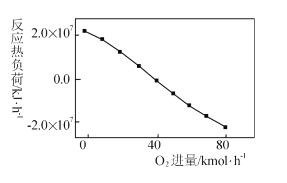
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
