题目内容
【题目】利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol
N2(g)+3H2(g)![]() 2NH3(g);△H=﹣92.4kJ/mol
2NH3(g);△H=﹣92.4kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=﹣483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为。
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。

写出石墨I电极上发生反应的电极反应式 ;
在电解池中生成N2O5的电极反应式为 。
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2molCH3OH,阴极产生标况下气体的体积为 L。
【答案】
(1)4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=﹣905.0kJ/mol;
(2)H2+CO32﹣﹣2e﹣=CO2+H2O;N2O4+2HNO3﹣2e﹣=2N2O5+2H+;
(3)13.44;
【解析】
试题分析:(1)N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol……①,N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol……②,2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol……③,由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=905.0kJ/mol;故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.0kJ/mol;
(2)燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2+CO32--2e-=CO2+H2O;N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+.故答案为:H2+CO32--2e-=CO2+H2O;N2O4+2HNO3-2e-=2N2O5+2H+;
(3)用该电池作电源,用惰性电极电解饱和NaCl溶液时,CH3OH-6e-+8OH-=CO32-+6H2O,每消耗0.2molCH3OH,转移电子1.2mol,阴极电极反应为2H++2e-=H2↑,产生标况下气体的体积=0.6mol×22.4L/mol=13.44L;故答案为:13.44。

 阅读快车系列答案
阅读快车系列答案【题目】碱式碳酸钴[ Cox(OH)y(CO3)2 ]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示进行实验。
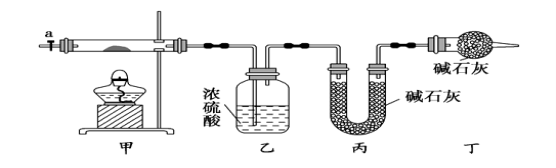
⑴请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中___________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
⑵步骤④中缓缓通入空气数分钟的目的是__________________。
⑶某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_____ _(填字母)连接在_____ ____(填装置连接位置)。

⑷若按正确装置进行实验,测得如下数据:
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为____________________。
⑸CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:

已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2 发生反应的离子方程式为______________________。
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为__________________。
③加盐酸调整PH为2~3的目的为____________________________。

