��Ŀ����
����Ŀ����ʽ̼����[ Cox��OH��y(CO3)2 ]���������Ӳ��ϣ����Բ��ϵ����Ӽ�������ʱ�ɷֽ��������������Ϊ��ȷ������ɣ�ij��ѧ��ȤС��ͬѧ�������ͼ��ʾ����ʵ�顣
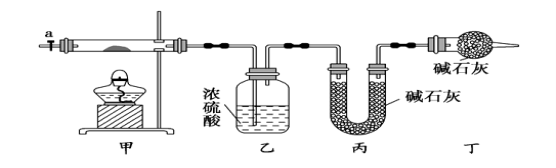
�����������ʵ�鲽�裺
�ٳ�ȡ3.65g��Ʒ����Ӳ�ʲ������ڣ������ҡ���װ�õ�������
�ڰ���ͼ��ʾװ����װ��������������װ�������ԣ�
�ۼ��ȼ��в����ܣ�����װ����___________����ʵ������ֹͣ���ȣ�
�ܴ���a������ͨ����������Ӻ����ҡ���װ�õ�������
�ݼ��㡣
��������л���ͨ����������ӵ�Ŀ����__________________��
��ijͬѧ��Ϊ����ʵ��װ���д���һ������ȱ�ݣ�Ϊ�����һ���⣬��ѡ������װ���е�_____ _(����ĸ)������_____ ____(��װ������λ��)��

��������ȷװ�ý���ʵ�飬����������ݣ�
��װ�õ�����/g | ��װ�õ�����/g | |
����ǰ | 80.00 | 62.00 |
���Ⱥ� | 80.36 | 62.88 |
��ü�ʽ̼���ܵĻ�ѧʽΪ____________________��
��CoCl2��6H2O���������ˮ������Ӽ����Ժ��ܷ��ϣ�������Fe��Al�����ʣ���ȡCoCl2��6H2O��һ�ֹ������£�

��֪��
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
��ʼ������PH�� | 2.3 | 7.5 | 7.6 | 3.4 |
��ȫ������PH�� | 4.1 | 9.7 | 9.2 | 5.2 |
�پ�������ʱ������H2O2 ������Ӧ�����ӷ���ʽΪ______________________��
�ڼ���CoCO3��PHΪ5.2~7.6����������õ������ɷ�Ϊ__________________��
�ۼ��������PHΪ2~3��Ŀ��Ϊ____________________________��
���𰸡������������ݲ���ʱ��1�֣�
����װ���в�����CO2��H2O��g��ȫ�������ҡ���װ���У�2�֣�
��D��1�֣�����aǰ����װ�ü�ǰ����1�֣���Co3(OH)4(CO3)2 ��3�֣�
�ɢ�2Fe2+��H2O2��2H��2Fe3+ ��2H2O��2�֣���Al(OH)3��Fe(OH)3 ��2�֣�
������CoCl2��ˮ�� ��2�֣�
��������
�����������1�����ȼ��в����ܣ�����װ���в��������ݲ���������ʽ̼���ֽܷ���ϣ�
��2���������л���ͨ����������ӣ���װ�������ɵ�CO2��H2Oȫ�������ҡ���װ���У�����Ӱ����������
��3���ڻ���aǰ����װװ��D��װ����ʢ�ŵļ�ʯ���������տ����е�ˮ�����Ͷ�����̼��
��4����ʽ̼������Ʒ3.65g����Ӧǰ��װ�õ�����Ϊ80.00g����Ӧ������Ϊ80.36g��������ˮ������Ϊ80.36g-80.00g=0.36g�����ʵ���Ϊ0.36g��18g/mol=0.02mol����Ӧǰ��װ�õ�����Ϊ62.00g����Ӧ������Ϊ62.00g�����ɶ�����̼������Ϊ62.88g-62.00g=0.88g�����ʵ���Ϊ0.88g��44g/mol��0.02mol���������ܵ�����Ϊ3.65g-0.36g-0.88g=2.41g�����ʵ���Ϊ2.41g��120g/mol=0.02mol������Co��H��CԪ���غ��֪��x��y��z=0.015mol��0.02mol��2��0.02mol=2��4��2���ʼ�ʽ̼���ܵĻ�ѧʽΪCo2��OH��4��CO3��2��
��5��������H2O2�Ѷ�������������Ϊ���������ӣ�������Ӧ�����ӷ���ʽΪ2Fe2+��H2O2��2H��2Fe3+ ��2H2O��������1�Ƿ���Fe��OH��3��Al��OH��3��Һ��IJ������ǹ��ˣ�ǰ�����pH��Ŀ���������������Ӻ�������ת��Ϊ���������Գ����ijɷ���Fe��OH��3��Al��OH��3�������������pHΪ2��3��Ŀ��Ϊ����COCl2��ˮ����

����Ŀ��������ͼ��ʾװ�ý���ʵ�飬������a�е���Һ����b�У�����c����ʢ��Һ��Ԥ������������ȷ����

ѡ�� | a | b | c | c�Թ������� |
A | Ũ���� | KMnO4 | FeCl2��Һ | ��Һ���ػ�ɫ |
B | ϡ���� | Na2S2O3 | ��ˮ | ����dz��ɫ���� |
C | ���� | Na2CO3 | Na2SiO3��Һ | ������ɫ���� |
D | Ũ���� | ��Ƭ | KI-������Һ | ��Һ����ɫ |
A. A B. B C. C D. D



