题目内容
【题目】水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1molL﹣1的NaOH溶液中,由水电离出的c(H+)=molL﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).25℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”). 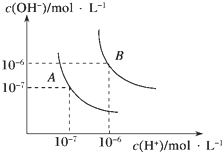
【答案】1×10﹣12;<;促进
【解析】解:25℃时纯水中c(H+)=c(OH﹣)=10﹣7 mol/L,Kw=c(H+)c(OH﹣)=10﹣14 ,当温度升高到100℃,纯水中c(H+)=c(OH﹣)=10﹣6 mol/L,Kw=c(H+)c(OH﹣)=10﹣12 ;100℃时1molL﹣1 的NaOH溶液中Kw=c(H+)c(OH﹣)=10﹣12 ;c(OH﹣)=1mol/L,水电离出的c(H+)=1×10﹣12;
水的电离时吸热过程,加热促进电离氢离子浓度和氢氧根离子浓度增大,Kw增大,所以Kw(25℃)<Kw(100℃);
NH4HCO3固体溶解后溶液中铵根离子水解生成一水合氨和氢离子,溶液呈酸性,碳酸氢根离子水解显碱性,水的电离被促进;
所以答案是:1×10﹣12;<;促进.
【考点精析】解答此题的关键在于理解离子积常数的相关知识,掌握水的离子积Kw=c(H+)·c(OH–)=10–14(25℃)①Kw只与温度有关,温度升高,Kw增大;如:100℃ Kw=10–12②Kw适用于纯水或稀酸、稀碱、稀盐水溶液中.

【题目】中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白: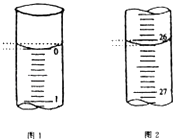
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是 . (写序号)
(2)选用的指示剂是 . (a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= .
(7)滴定终点的判定依据是 .