题目内容
下列说法正确的是
| A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
| C.常温下,向10mL PH=3的醋酸溶液中加水稀释后,溶液中C(CH3COO--)/C(CH3COOH) C(OH--)的值减小 |
| D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH)/c(NH3·H2O)的值增大 |
D
解析试题分析:A、外加盐不一定会影响水的电离程度,如外加氯化钠对水的电离无影响,错误;B、Ksp与难溶电解质的性质和温度有关,与溶液中相关离子的浓度无关,错误;C、常温下,向10mL PH=3的醋酸溶液中加水稀释后,Ka(CH3COOH)、Kw不变,溶液中C(CH3COO--)/C(CH3COOH) C(OH--)=Ka(CH3COOH)/Kw的值不变,错误;D、常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH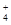 )/c(NH3·H2O)的值增大,正确。
)/c(NH3·H2O)的值增大,正确。
考点:考查水溶液中的离子平衡。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
一定温度时,向饱和的BaSO4溶液中加水,下列叙述正确的是
| A.BaSO4溶解度增大,Ksp不变 | B.BaSO4溶解度、Ksp均增大 |
| C.BaSO4溶解度不变,Ksp增大 | D.BaSO4溶解度、Ksp均不变 |
下列说法正确的是
| A.常温下,某溶液中由水电离出的c(H+)=1×10-amo1·L–1,若a<7时,则该溶液可能为NaHSO4溶液 |
| B.常温下,中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸)=V(醋酸) |
| C.25℃时,已知Ka(CH3COOH)=1.7×10-5mo1·L–1、Ka(C6H5OH) =1.0×10-10mo1·L–1、 Ka1(H2CO3) = 4.2×10-7mo1·L–1 、Ka2(H2CO3) =5.6×10-11mo1·L–1pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:②<③<① |
| D.常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸有气泡产生,说明常温下Ksp(BaSO4)>Ksp(BaCO3) |
常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是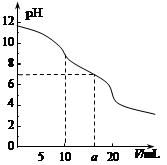
| A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-) |
| B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-) |
| C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3)[来源:学*科*网] |
| D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
下列物质的水溶液中,呈碱性的是
| A.Na2CO3 | B.Na2SO4 | C.NH4Cl | D.KAl (SO4) 2 |
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
| A.HCN易溶于水 |
| B.HCN溶液能导电 |
| C.1mol/L氢氰酸溶液的pH约为3 |
| D.10 mL1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应 |
将pH=5的H2SO4溶液稀释1000倍后,溶液中SO42-离子浓度与H+离子浓度的比值约为( )
| A.1:10 | B.1:1 | C.1:2 | D.1:20 |
在Na2S溶液中下列关系不正确的是( )
| A.c(Na+)=2c(HS-)+c(S2-)+c(H2S) |
| B.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C.c(Na+)> c(S2-)>c(OH-)>c(HS-) |
| D.c(OH-)=c(HS-)+c(H+)+2c(H2S) |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中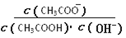 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH<7 |