题目内容
2.用ClO4-离子在酸性条件下将XO32-离子氧化,本身倍还原为Cl-,已知反应消耗的ClO4-与XO32-离子数之比为1:4,则元素X在氧化产物中的化合价是( )| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
分析 ClO4-离子在酸性条件下将XO32-离子氧化,本身倍还原为Cl-,Cl元素的化合价由+7价降低为-1价,则X的化合价升高,利用电子守恒计算解答.
解答 解:ClO4-离子在酸性条件下将XO32-离子氧化,本身倍还原为Cl-,Cl元素的化合价由+7价降低为-1价,则X的化合价升高,已知反应消耗的ClO4-与XO32-离子数之比为1:4,元素X在氧化产物中的化合价是n,
由电子守恒可知,1×[7-(-1)]=4×(n-4),
解得n=+6,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握氧化还原反应中元素的化合价升降及电子守恒是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
12.下列各反应中属于加成反应的是( )
| A. | C2H4+3O2$\stackrel{点燃}{→}$2CO2+2H2O | |
| B. | H2+Cl2$\stackrel{光照}{→}$2HCl | |
| C. | CH2=CH2+Br2→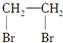 | |
| D. | CH3-CH3+2Cl2$\stackrel{催化剂}{→}$CH2Cl-CH2Cl+2HCl |
10.如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 ;
;
(2)地壳中含量最多的金属元素是Al,写出元素⑥③以原子个数比1:1形成化合物的电子式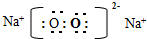 ;
;
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH;
(4)写出②⑦⑩对应离子还原性由强到弱的次序S2-Cl-F-.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑥ | ② | |||||
| 三 | ③ | ⑤ | ④ | ⑩ | ⑦ | ⑧ | ||
| 四 | ⑨ |
 ;
;(2)地壳中含量最多的金属元素是Al,写出元素⑥③以原子个数比1:1形成化合物的电子式
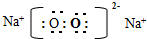 ;
;(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH;
(4)写出②⑦⑩对应离子还原性由强到弱的次序S2-Cl-F-.
17.下列每组中的两对物质,都能用分液漏斗分离且水层能从分液漏斗的下口放出( )
| A. | 蔗糖和水、汽油和水 | B. | 酒精和水 苯和水 | ||
| C. | 食用油和水、汽油和水 | D. | 食用油和水、四氯化碳和水 |
7.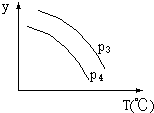 在一密闭容器中,有下列的可逆反应:A(g)+B(g)?X(g)△H<0,试判断对图4的说法中正确的是(T表示温度,P表示压强)( )
在一密闭容器中,有下列的可逆反应:A(g)+B(g)?X(g)△H<0,试判断对图4的说法中正确的是(T表示温度,P表示压强)( )
 在一密闭容器中,有下列的可逆反应:A(g)+B(g)?X(g)△H<0,试判断对图4的说法中正确的是(T表示温度,P表示压强)( )
在一密闭容器中,有下列的可逆反应:A(g)+B(g)?X(g)△H<0,试判断对图4的说法中正确的是(T表示温度,P表示压强)( )| A. | P3>P4,y轴表示B的转化率 | |
| B. | P3<P4,y轴表示X的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |
14.下列关于实验操作的陈述中正确的是( )
| A. | 受热后的蒸发皿要用坩埚钳夹取,并放在石棉网上冷却 | |
| B. | 稀释浓硫酸时,应在量筒中先加入一定量水,再沿器壁缓慢注入浓硫酸,并用玻璃棒搅拌 | |
| C. | 过滤时,为了加速溶液透过滤纸,可以用玻璃棒末端轻轻搅拌滤纸上的混合物 | |
| D. | 不慎将桌面上的酒精灯打翻引起小面积着火时,应迅速用水扑灭火 |
11.下列说法正确的是( )
| A. | 卫生部公告2011年5月1日起全面叫停面粉增白剂,由此可知:应当严格禁止在食品中使用任何食品添加剂 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | 往稀米粥中加入少量加碘食盐,能检验食盐中是否含碘 | |
| D. | 处理废水时加入明矾作为净水剂可以除去水中悬浮的杂质 |
12.下列说法错误的是( )
| A. | 阿司匹林属于解热镇痛药 | |
| B. | 青霉素有青霉素F、G、X、K、V | |
| C. | 胃舒平、苏打片均属于抗酸药 | |
| D. | 青霉素在体内水解可得到一类碱性物质 |