题目内容
甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲的单质与水反应的离子方程式为 ;
(2)乙元素在周期表中的位置为 ;
(3)丙元素的最高价氧化物的电子式为 ;
(4)甲与丁两种元素可组成的具有强氧化性的物质是 。(填化学式)
(1)甲的单质与水反应的离子方程式为 ;
(2)乙元素在周期表中的位置为 ;
(3)丙元素的最高价氧化物的电子式为 ;
(4)甲与丁两种元素可组成的具有强氧化性的物质是 。(填化学式)
(8分)(1)2Na+2H2O=2Na++H2↑ ⑵ 第二周期ⅡA族 ⑶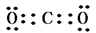 ⑷ Na2O2
⑷ Na2O2
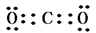 ⑷ Na2O2
⑷ Na2O2试题分析:乙原子中K层与M层电子数相等,所以乙是Mg。甲原子的核外电子数比乙原子核外电子数少1,则甲是钠元素。丙原子的最外层电子数是次外层电子数的2倍,因此丙是碳元素。丁原子核电荷数比丙原子核电荷数多2,所以丁是氧元素。
(1)钠是活泼的金属,极易和水反应生成氢氧化钠和氢气,反应的化学方程式是2Na+2H2O=2Na++H2↑。
(2)镁是12号元素,位于元素周期表的第二周期ⅡA族。
(3)碳元素的最高价氧化物是CO2,含有极性键的共价化合物,电子式是
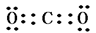 。
。(4)钠和氧元素形成的具有强氧化性的物质是过氧化钠,化学式是Na2O2。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案
相关题目
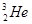 ,而在地球上氦元素则主要以
,而在地球上氦元素则主要以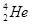 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是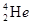 原子核内含有4个质子
原子核内含有4个质子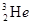 与
与
 +
+  ——
——  +
+ 
 ——
——  +
+  +
+ 
