题目内容
表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
(1)证明⑨的非金属性比⑧强的实验事实是 ;
②的单质与③、⑧的最高价氧化物对应水化物的浓溶液都能发生反应,与⑧反应的化学方程式为 。
(2)现有Z、W两种中学化学中的常见物质,它们由①、③、④中的两种或三种元素组成。Z的浓溶液常温下能使铁钝化,由此可知Z的化学式为 ;W中①、③两种元素的质量比为3:14,写出W的电子式 ;W与④的单质在催化剂、加热条件下发生的反应是工业制取Z的基础,写出该反应的化学方程式: 。
(3)电动汽车的某种燃料电池,通常用NaOH作电解质,用⑥的单质、石墨作电极,在石墨电极一侧通入空气,该电池负极的电极反应 。
⑧的一种氧化物,通常情况为气体,是形成酸雨的主要原因之一,可利用某种燃料电池,通常用硫酸溶液作电解质,用石墨作电极,在一端通入空气,另一端通入该气体,该电池负极的电极反应 。该燃料电池的产物为 。
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
(1)证明⑨的非金属性比⑧强的实验事实是 ;
②的单质与③、⑧的最高价氧化物对应水化物的浓溶液都能发生反应,与⑧反应的化学方程式为 。
(2)现有Z、W两种中学化学中的常见物质,它们由①、③、④中的两种或三种元素组成。Z的浓溶液常温下能使铁钝化,由此可知Z的化学式为 ;W中①、③两种元素的质量比为3:14,写出W的电子式 ;W与④的单质在催化剂、加热条件下发生的反应是工业制取Z的基础,写出该反应的化学方程式: 。
(3)电动汽车的某种燃料电池,通常用NaOH作电解质,用⑥的单质、石墨作电极,在石墨电极一侧通入空气,该电池负极的电极反应 。
⑧的一种氧化物,通常情况为气体,是形成酸雨的主要原因之一,可利用某种燃料电池,通常用硫酸溶液作电解质,用石墨作电极,在一端通入空气,另一端通入该气体,该电池负极的电极反应 。该燃料电池的产物为 。
(1)酸性HClO4>H2SO4;C+2H2SO4(浓)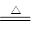 CO2↑+2SO2↑+H2O
CO2↑+2SO2↑+H2O
(2)HNO3;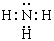 ;4NH3+5O2
;4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)Al-3e-+4OH-=AlO2-+2H2O;SO2-2e-+2H2O=SO42-+4H+;硫酸
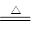 CO2↑+2SO2↑+H2O
CO2↑+2SO2↑+H2O (2)HNO3;
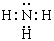 ;4NH3+5O2
;4NH3+5O2 4NO+6H2O
4NO+6H2O(3)Al-3e-+4OH-=AlO2-+2H2O;SO2-2e-+2H2O=SO42-+4H+;硫酸
试题分析:根据元素在周期表中的相对位置可知,①~⑨分别是H、C、N、O、Na、Al、Si、S、Cl。
(1)非金属性越强,最高价氧化物的水化物的酸性越强,由于酸性是HClO4>H2SO4,所以氯元素的非金属性强于S元素的。浓硫酸强于强氧化性,能与碳单质反应,方程式是C+2H2SO4(浓)
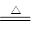 CO2↑+2SO2↑+H2O。
CO2↑+2SO2↑+H2O。(2)Z的浓溶液常温下能使铁钝化,由此可知Z的化学式为,所以Z是硝酸。W中①、③两种元素的质量比为3:14,写出W的电子式,则W是氨气,含有极性键的共价化合物,电子式是
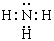 ;氨气在催化剂的作用下,发生催化氧化生成NO和水,反应的方程式是4NH3+5O2
;氨气在催化剂的作用下,发生催化氧化生成NO和水,反应的方程式是4NH3+5O2 4NO+6H2O。
4NO+6H2O。(3)原电池中负极失去电子,金属铝能和氢氧化钠溶液反应,则反应的电极反应式是Al-3e-+4OH-=AlO2-+2H2O;⑧的一种氧化物,通常情况为气体,是形成酸雨的主要原因之一,则该气体是SO2。SO2在反应中失去电子,则负极通入SO2,电极反应式是SO2-2e-+2H2O=SO42-+4H+;根据反应电极反应式可知,该燃料电池的产物是硫酸。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目
 和
和 
 和
和 
 和
和 
 和
和 