题目内容
蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池放电时,发生还原反应的物质是 (填字母,下同)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)下列有关该电池的说法中正确的是
A.放电时电解质溶液显强酸性
B.放电时5.6g Fe全部转化为Fe(OH)2时,外电路中通过了0.2 mol电子
C.充电时阳极反应为Ni(OH)2+2OH-?2e-==NiO2+2H2O
D.充电时阴极附近溶液的碱性保持不变
(3)用此蓄电池电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL,电解池的电极均为惰性电极。当溶液中的Cu2+ 全部转化成Cu时,阳极产生的气体在标准状况下的体积为 ;将电解后的溶液加水稀释至1L,此时溶液的pH= 。
(4)用此蓄电池进行电解,且电解池的电极均为铜电极,电解质溶液为浓碱液与NaCl溶液的混合液,电解一段时间后,同学们惊奇地发现,阳极附近不是生成蓝色沉淀,而是生成红色沉淀,查阅资料得知该红色沉淀是Cu2O。写出该阳极上的电极反应式: 。
 Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2(1)该蓄电池放电时,发生还原反应的物质是 (填字母,下同)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)下列有关该电池的说法中正确的是
A.放电时电解质溶液显强酸性
B.放电时5.6g Fe全部转化为Fe(OH)2时,外电路中通过了0.2 mol电子
C.充电时阳极反应为Ni(OH)2+2OH-?2e-==NiO2+2H2O
D.充电时阴极附近溶液的碱性保持不变
(3)用此蓄电池电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL,电解池的电极均为惰性电极。当溶液中的Cu2+ 全部转化成Cu时,阳极产生的气体在标准状况下的体积为 ;将电解后的溶液加水稀释至1L,此时溶液的pH= 。
(4)用此蓄电池进行电解,且电解池的电极均为铜电极,电解质溶液为浓碱液与NaCl溶液的混合液,电解一段时间后,同学们惊奇地发现,阳极附近不是生成蓝色沉淀,而是生成红色沉淀,查阅资料得知该红色沉淀是Cu2O。写出该阳极上的电极反应式: 。
(1)A (2)B、C (3)0.168L 2
(4)2Cu+2OH-?2e-=Cu2O+H2O
(4)2Cu+2OH-?2e-=Cu2O+H2O
试题分析:(1)还原反应是化合价降低的物质发生的,NiO2生成Ni(OH)2化合价由+4降到+2,(3)电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL转移0.02 mol电子时先是氯离子失去电子,然后是水中OH-失去电子,各失去电子0.01 mol,产生Cl2 0.005 mol,O2 0.002 5 mol,共0.007 5 mol,体积为0.007 5 mol×22.4 L·mol-1="0.168" L, OH-失去电子0.01 mol同时产生0.01 mol H+,稀释至1 L时c(H+)="0.01" mol·L-1,pH为2。
(4)由信息可知电极反应为:2Cu+2OH-?2e- = Cu2O+H2O

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
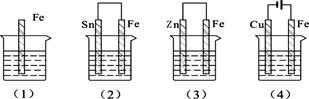
 ⑶生产普通玻璃和硅酸盐水泥所需用到的共同原料是 ,导电塑料可表示为
⑶生产普通玻璃和硅酸盐水泥所需用到的共同原料是 ,导电塑料可表示为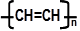 ,它属于 材料(填序号)
,它属于 材料(填序号)