题目内容
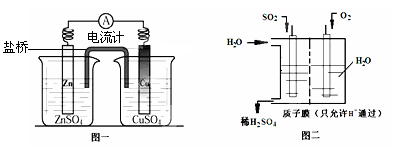
某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。请回答:
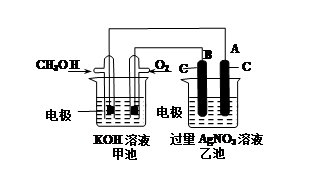
①通入O2的电极名称是 ,B电极的名称是 。
②通入CH3OH的电极的电极反应式是 ,A电极的电极反应式为 。
③乙池体积为1L,在AgNO3足量的情况下电解一段时间后溶液的PH变为1,则在这段时间内转移的电子数目为

①通入O2的电极名称是 ,B电极的名称是 。
②通入CH3OH的电极的电极反应式是 ,A电极的电极反应式为 。
③乙池体积为1L,在AgNO3足量的情况下电解一段时间后溶液的PH变为1,则在这段时间内转移的电子数目为
①正 阳 (各1分)
②CH3OH+8OH-+6e-=CO32-+6H2O(2分) Ag++ e-=Ag(2分)
③0.1NA(2分)
②CH3OH+8OH-+6e-=CO32-+6H2O(2分) Ag++ e-=Ag(2分)
③0.1NA(2分)
试题分析:这是一个燃料电池,燃料电池中燃料总是电池的负极,氧气一定是电池的正极,在乙池中,是一个电解池,连接电池正极的是电解池的阳极,连接电池负极的是电解池的阴极,电解硝酸银溶液,电极材料都是惰性电极,阳极上是阴离子氢氧根离子放电,阴极上是银离子放电。在乙池中,电极反应为:阳极:4OH——4e-=O2↑+2H2O,当溶液的PH变为1时,溶液中的c(H+)=0.1mol/L那么n(H+)=0.1mol,也就是说,消耗掉的氢氧根就是0.1mol,那么从电极方程式中可以看出,在这段时间内转移的电子物质的量为0.1mol,电子数目为0.1NA。

练习册系列答案
相关题目
 Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2