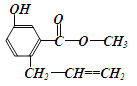
题目内容
【题目】分别将镁条和铝条平行插人盛有一定浓度稀盐酸、NaOH的烧杯中,用导线和电流计连接成两个原电池,装置如图所示。原电池工作时,下列叙述正确的是
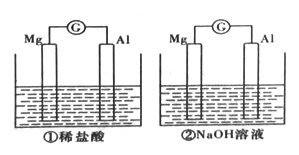
A. 因为Mg比Al活泼,所以两个原电池中负极都是Mg
B. 两个原电池中,电子都是由镁条通过导线流向铝条
C. 两个原电池中,反应放出的能量都完全转化成电能
D. 两个原电池中,正极都有氢气生成
【答案】D
【解析】第一个装置中电解质为稀盐酸,Mg、Al均能与盐酸反应,Mg比Al活泼,Mg作负极,Al作正极;第二个装置中电解质为NaOH,Mg不与NaOH溶液反应而Al能与NaOH溶液发生自发的氧化还原反应,故负极为Al,正极为Mg。
A、根据上分析可知第一个装置中Mg为负极,第二个装置中Al为负极,A错误。
B、第一个装置中电子由Mg条通过导线流向Al条,第二个装置中电子由Al条通过导线流向Mg条,B错误。C、原电池中,化学能不可能全部转化为电能,C错误。D、两个装置中正极都是氢离子得电子生成氢气,在正极会有氢气产生,D正确。正确答案为D

【题目】现有一瓶A和B的混合物,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm—3 | 溶解性 |
A | —11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是
A. 蒸馏 B. 蒸发 C. 分液 D. 过滤
【题目】亚硝酸为弱酸,其钠盐(亚硝酸钠NaNO2)外观酷似食盐且有咸味,过量使用会使人中毒。其银盐不溶于水。某化学兴趣小组对亚硝酸钠的制备进行了探究。
(1)请设计一种简单方法鉴别NaCl和NaNO2 :___________。
(2)利用如图完成一氧化氮与过氧化钠反应制备业硝酸钠。查阅资料:2NO + Na2O2 =2NaNO2, 2NO2+ Na2O2=2NaNO3, NO 能被酸性高锰酸钾氧化为NO3-。回答下列问题:

① 检查装置气密性后,应进行的操作是_________。
② 装置B 中Cu 参与反应的离子方程式为______,装置C 的作用是______。
③ 装置E发生反应的离子方程式为________。
④ 同学们经过讨论认为上述装置仍然存在缺陷,D中生成的产物不纯,D管中可能含有的杂质为________(填化学式),你认为应该进行的改进是__________。
(3)测定制取样品中NaNO2的纯度。
步骤:a.在5个有编号的带刻度的试管中分别加入不同体积、相同浓度的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL,并振荡,制成标准色阶;
试管编号 | ① | ② | ③ | ④ | ⑤ |
NaNO2含量(mg/L) | 0 | 20 | 40 | 60 | 80 |
b.称量0.10g制得的样品,溶于水配成500mL溶液。取5mL待测液,加入1mLM,再加入蒸馏水至l0mL,并振荡,与标准色阶比较。
比较结果:待测液与④标准色阶相同,则制取样品中NaNO2的纯度是________。
查阅资料可知:维生素C可有效降低NaNO2的含量。请完成下列实验验证方案:取5 mL 待测液,加入______,振荡,再加入1mL M溶液,_____,再振荡,与④ 标准色阶对比。实验现象为紫红色比④ 标准色阶浅,则证明维生素C可以有效降低NaNO2的含量。