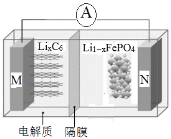
题目内容
【题目】铝热反应是铝的一个重要性质。


(1)按如图装置进行实验,可观察到反应剧烈,火星四射,漏斗下方有红热熔融物“铁块”流出。
该反应的化学方程式为_____,其能量变化为如图中的______(填“A”或“B”)所示。

(2)某校化学兴趣小组同学,为了测定铝热反应后得到“铁块”混合物中铝的含量。取“铁块”样品研碎称得质量为x g,加入如图装置,再滴入足量NaOH溶液充分反应,测量生成气体体积为a ml(标况)。
①仪器A的名称为_______。
②写出样品中Al与NaOH反应的化学方程式_______。
③该小组同学改进实验,用恒压漏斗(如图)代替仪器A,其优点有________(写2点)。
④该样品中铝的含量为_________。
【答案】 2Al+Fe2O3 ![]() Al2O3+2Fe A 分液漏斗 2Al+2OH+6H2O=2[Al(OH)4]+3H2 让液体顺利滴入锥形瓶;降低液体体积对气体体积造成偏大的误差 9a/11200x
Al2O3+2Fe A 分液漏斗 2Al+2OH+6H2O=2[Al(OH)4]+3H2 让液体顺利滴入锥形瓶;降低液体体积对气体体积造成偏大的误差 9a/11200x
【解析】(1)Al还原Fe2O3生成Fe和Al2O3,配平可得化学方程式:2Al+Fe2O3![]() Al2O3+2Fe。该反应是放热反应,其能量变化为如图中的A所示。(2)①仪器A是是分液漏斗;②铝和氢氧化钠溶液反应的离子方程式为2Al+2OH+6H2O=2[Al(OH)4]+3H2↑;③恒压漏斗的作用是让液体顺利滴入锥形瓶,同时降低液体体积对气体体积造成偏大的误差;④氢气物质的量是
Al2O3+2Fe。该反应是放热反应,其能量变化为如图中的A所示。(2)①仪器A是是分液漏斗;②铝和氢氧化钠溶液反应的离子方程式为2Al+2OH+6H2O=2[Al(OH)4]+3H2↑;③恒压漏斗的作用是让液体顺利滴入锥形瓶,同时降低液体体积对气体体积造成偏大的误差;④氢气物质的量是![]() ,根据方程式可知消耗铝是
,根据方程式可知消耗铝是![]() ,因此该样品中铝的含量为
,因此该样品中铝的含量为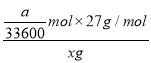 =9a/11200x。
=9a/11200x。

 习题精选系列答案
习题精选系列答案【题目】Ⅰ.常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ·mol-1)
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
C-F | 427 | C-Cl | 330 | C-I | 218 |
H-H | 436 | S=S | 255 | H-S | 339 |
回答下列问题:
写出H2(g)与S2(g)反应生成H2S(g)的热化学方程式____________________________。
Ⅱ.某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:

(1)该反应的化学方程式为___________________。
(2)反应开始至2 min,用Y表示的平均反应速率为_____________,X的转化率为_________。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是________。
A.X、Y、Z的浓度相等
B.X、Y、Z的分子数比为3︰1︰2
C.Z的生成速率是Y的生成速率的二倍
D.单位时间内生成n mol Y,同时生成3n mol X
Ⅲ.如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为: ________________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。