题目内容
【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3)的原理如下图:

(1)二甲醚的合成反应:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g) ΔH1
CH3OCH3(g)+CO2(g) ΔH1
①已知CO、H2与CH3OCH的燃烧热(ΔH)分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、(a、b、c均小于0),则ΔH1=________kJ·mol-1。
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能_______(填标号)。
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
ⅰ. CH4(g)+Fe3O4(s)![]() CO(g)+2H2(g)+3Fe(s)
CO(g)+2H2(g)+3Fe(s)
ⅱ. CH4(g)+4Fe3O4(s)![]() CO2(g)+2H2O(g)+12FeO(s)
CO2(g)+2H2O(g)+12FeO(s)
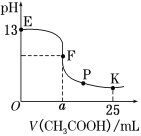
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如下图。

①随着压强的增大,反应ⅰ的平衡常数K值________(填“增大”、“减小”、 或“不变”)
②结合图像,分析H2O的体积分数变化的原因_________(用化学方程式表示)
(3)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g)+3FeO(s)![]() Fe3O4(s)+ CO (g) ΔH2
Fe3O4(s)+ CO (g) ΔH2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表:
温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①ΔH2_______0(填“>”或“<”)。
②若在150℃时进行上述转化,理论转化率ɑ(FeO)=___________。
③在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.体系的压强不变 B.CO2的物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2还原器温度设置在170℃的原因___________。
【答案】 (3a+3b-c) BC 不变 Fe3O4+H2![]() 3FeO+H2O < 100% C 温度过高,CO2的转化率低;温度过低,反应速率比较慢
3FeO+H2O < 100% C 温度过高,CO2的转化率低;温度过低,反应速率比较慢
【解析】(1)二甲醚的合成反应:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g) ΔH1
CH3OCH3(g)+CO2(g) ΔH1
①已知:②CO(g)+ ![]() O2(g)=CO2(g) ΔH2=a kJ·mol-1,③H2(g)+
O2(g)=CO2(g) ΔH2=a kJ·mol-1,③H2(g)+ ![]() O2(g)=H2O(l) ΔH3=b kJ·mol-1, ④CH3OCH3(g)+3O2(g)=3H2O(l) +2CO2(g) ΔH4=c kJ·mol-1,根据盖斯定律可知,②×3+③×3-④可得3CO(g)+3H2(g)
O2(g)=H2O(l) ΔH3=b kJ·mol-1, ④CH3OCH3(g)+3O2(g)=3H2O(l) +2CO2(g) ΔH4=c kJ·mol-1,根据盖斯定律可知,②×3+③×3-④可得3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g) ,则ΔH1=(3a+3b-c)kJ·mol-1;
CH3OCH3(g)+CO2(g) ,则ΔH1=(3a+3b-c)kJ·mol-1;
②催化剂能降低反应所需要的活化能,不影响焓变,同等程度加快正逆反应速率,平衡不移动,故答案为BC;
(2)①反应方程式的系数确定后,平衡常数只与温度有关,温度不变,平衡常数不变,故改变压强,K值不变;
②结合图像可以看出H2O的体积分数变大的同时H2的体积分数在减小,所以发生的反应是Fe3O4+H2![]() 3FeO+H2O ;
3FeO+H2O ;
(3)①根据表中数据可以看出,随着温度的升高,CO2的体积分数变大,CO的体积分数变小,说明平衡逆向移动,而温度升高,平衡朝吸热方向移动,说明逆向是吸热的,那么正向是放热的,即ΔH2<0;
②由图表可以看出温度从100℃上升到170℃,CO2和CO的体积分数都没变,说明这个区域内虽然温度变化,但是平衡没有移动,理论上已经全部转化了,所以理论值是100%;
③反应CO2(g)+3FeO(s)![]() Fe3O4(s)+ CO (g)是前后体积不变的反应,所以压强不变不能判断是否达到平衡,A错误;由第②问可以看出温度从100℃上升到170℃,已经完全转化了,此时CO2和CO的体积分数都没变,但是此时不算平衡状态,所以B和D错误;只有C是根据化学平衡的定义描述的,即平衡时正逆反应速率相等且不0,故C正确,答案为C。
Fe3O4(s)+ CO (g)是前后体积不变的反应,所以压强不变不能判断是否达到平衡,A错误;由第②问可以看出温度从100℃上升到170℃,已经完全转化了,此时CO2和CO的体积分数都没变,但是此时不算平衡状态,所以B和D错误;只有C是根据化学平衡的定义描述的,即平衡时正逆反应速率相等且不0,故C正确,答案为C。
④温度选择170℃从平衡的角度分析,是因为温度过高,CO2的转化率会变低,而从速率的角度分析,温度过低又会使反应速率变慢,则应选择一个合适的温度。

 阅读快车系列答案
阅读快车系列答案【题目】有甲、乙两位同学,他们一起做了如图所示的水果电池实验,测得数据如下表:
实验次数 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
1 | 锌 | 铜 | 菠萝 | 3 | 900 |
2 | 锌 | 铜 | 苹果 | 3 | 650 |
3 | 锌 | 铜 | 柑橘 | 3 | 850 |
4 | 锌 | 铜 | 西红柿 | 3 | 750 |
5 | 锌 | 铝 | 菠萝 | 3 | 650 |
6 | 锌 | 铝 | 苹果 | 3 | 450 |
甲同学提出的问题,乙同学解释不正确的是
①甲:实验6中的负极反应如何写? 乙:铝为负极:Al-3e-===Al3+
②甲:实验1、5电流方向为什么相反? 乙:实验1中锌为负极,电流由铜经导线流向锌;实验5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关? 乙:只跟水果的品种有关。
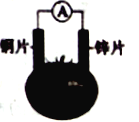
A. ③ B. ① C. ①②③ D. ②③