题目内容
硫酸厂用煅烧黄铁矿(FeS2)制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2制备绿矾。
(一)SO2和O2反应制取的反应原理为:2SO2+O2 2SO3,在一密闭容器中一定时间内达到平衡。
2SO3,在一密闭容器中一定时间内达到平衡。
(1)该反应的平衡常数表达式为______。
(2)该反应达到平衡状态的标志是______。
| A.v(SO2)=v(SO3) | B.混合物的平均相对分子质量不变 |
| C.混合气体质量不变 | D.各组分的体积分数不变 |
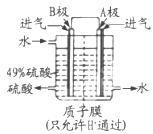
(3)B电极的电极反应式为______;溶液中H+的移动方向由______极到______极;电池总反应式为______。
(三)利用烧渣制绿矾的过程如下

测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL。溶液。
b.量取25 ml。待测液于锥形瓶中。
c.用硫酸酸化的0. 01 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL。根据上述步骤同答下列问题。
(4)滴定时发生反应的离子方程式为(完成并配平离子反应方程式)。

(5)用硫酸酸化的KMnO4滴定终点的标志是
(6)计算上述产品中的FeSO4.7H2O质量分数为______。
(1)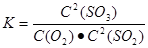 (2) B D (3)SO2+2H2O-2e-=SO42-+4H+ B A
(2) B D (3)SO2+2H2O-2e-=SO42-+4H+ B A
2SO2+O2+2H2O=2H2SO4(或2SO2+O2+2H2O=4H++2SO42-)(4)5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
(5)滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色。(6)0.975或97.5%
解析试题分析:(1)反应2SO2+O2 2SO3的平衡常数表达式为
2SO3的平衡常数表达式为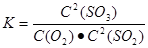 (2)A没有指明是正反应速率还是逆反应速率,没有意义。错误。B.由于该反应是反应前后气体体积不等的反应,所以当反应达到平衡时各种气体的物质的量不变,则混合物的平均相对分子质量不变。正确。C.任何反应无论进行到什么程度,混合气体质量总是不变,=。因此不能作为反应达到平衡状态的标志。错误。D.由于该反应是反应前后气体体积不等的反应,所以当反应达到平衡时各种气体的物质的量不变,各种气体的体积也不变,总体积不变,所以各组分的体积分数不变。正确。所以该反应达到平衡状态的标志是B D。(3)因为在B电极区产生H2SO4,说明SO2在B电极上失去电子,因此B电极为阳极,电极反应式为SO2+2H2O-2e-=SO42-+4H+根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中H+的移动方向由B电极到A电极。电池总反应式为2SO2+O2+2H2O=2H2SO4。(4)滴定时发生反应的离子方程式为5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。(5)由于KMnO4为紫色,所以不用外加指示剂,利用其本身的颜色变化来判断反应终点。因此用硫酸酸化的KMnO4滴定终点的标志是滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色。n(KMnO4)= 0. 01 mol/L×0.04L×(250÷25)=4×10-3mol.则n(Fe2+)=5 n(KMnO4)= 5×4×10-3mol=0.02mol.所以上述产品中的FeSO4.7H2O质量分数为(0.02mol×278g/mol) ÷5.7 g×100%=97.5%.
(2)A没有指明是正反应速率还是逆反应速率,没有意义。错误。B.由于该反应是反应前后气体体积不等的反应,所以当反应达到平衡时各种气体的物质的量不变,则混合物的平均相对分子质量不变。正确。C.任何反应无论进行到什么程度,混合气体质量总是不变,=。因此不能作为反应达到平衡状态的标志。错误。D.由于该反应是反应前后气体体积不等的反应,所以当反应达到平衡时各种气体的物质的量不变,各种气体的体积也不变,总体积不变,所以各组分的体积分数不变。正确。所以该反应达到平衡状态的标志是B D。(3)因为在B电极区产生H2SO4,说明SO2在B电极上失去电子,因此B电极为阳极,电极反应式为SO2+2H2O-2e-=SO42-+4H+根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中H+的移动方向由B电极到A电极。电池总反应式为2SO2+O2+2H2O=2H2SO4。(4)滴定时发生反应的离子方程式为5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。(5)由于KMnO4为紫色,所以不用外加指示剂,利用其本身的颜色变化来判断反应终点。因此用硫酸酸化的KMnO4滴定终点的标志是滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色。n(KMnO4)= 0. 01 mol/L×0.04L×(250÷25)=4×10-3mol.则n(Fe2+)=5 n(KMnO4)= 5×4×10-3mol=0.02mol.所以上述产品中的FeSO4.7H2O质量分数为(0.02mol×278g/mol) ÷5.7 g×100%=97.5%.
考点:考查煅烧黄铁矿制取硫酸、用硫酸厂烧渣制备绿矾的反应原理及相应的化学计算的知识。

Ⅰ.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是 。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
每生成1 mol P4时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2 +I2
+I2 S4
S4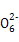 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是 mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I +5S
+5S +2H+
+2H+ I2+5S
I2+5S +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| | 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol/LNa2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 | |
该实验的目的是 ;表中V2= mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是 。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O
 Ce(OH)4↓+ 。
Ce(OH)4↓+ 。 (1)在下列反应中:
| A.2F2+2H2O=4HF+O2↑; | B.2Na+2H2O=2NaOH +H2↑; | C.CaO+H2O=Ca(OH)2; | D.2H2O 2H2↑+O2↑。其中(填序号): 2H2↑+O2↑。其中(填序号): |
(2)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式并用“单线桥法”表示出电子转移的方向和数目:___________________
当化学反应中电子转移的数目为3.01×1023个时,则生成的氯气在标准状况时的体积为 L。
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
| A.Na2O2 + 2HCl =" 2NaCl" + H2O2 |
| B.Ag2O + H2O2 =" 2Ag" + O2↑ + H2O |
| C.2H2O2 = 2H2O + O2↑ |
| D.3H2O2 + Cr2(SO4)3 + 10KOH = 2K2CrO4 + 3K2SO4 + 8H2O |
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是__________。

(3)某强酸性反应体系中,反应物和生成物共六种物质或离子:O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。
①该反应的离子方程式是__________ 。
②如果上述反应中有2.24L(标准状况)气体生成,转移的电子的物质的量为__________mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2 + H2O =" A" + NH3↑,试指出生成物A的化学式为__________,并阐明H2O2被称为“绿色氧化剂”的理由是_______________。
(5)请设计一个简单易行的实验证明过氧化氢具有氧化性。除过氧化氢外,供选择的试剂还有:氯水、稀硝酸、饱和硫化氢溶液。请将所选试剂和实验现象填入下表:
| 实验内容 | 试剂 | 实验现象 |
| 验证氧化性 | | |
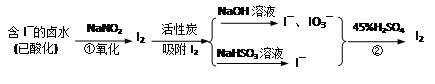
 H2SO3 + OH– 和 ② (写出离子方程式)
H2SO3 + OH– 和 ② (写出离子方程式) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。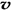 (N2)/
(N2)/ 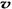 (O2)=2:3
(O2)=2:3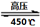 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2 Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2 MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中