题目内容
活性炭吸附法是工业提碘的主要方法之一。其流程如下: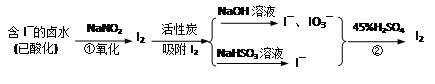
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将 I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的数目和方向 。
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,可能的原因是什么? 。
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体。解释产生这种现象的原因 ,所以,反应②需要在 条件下进行。
(4)流程中,碘元素经过了I2→I-、IO3-→I2的变化过程,这样反复的原因是 。
(5)流程中用到的NaHSO3溶液显弱酸性。是因为该溶液中存在以下的平衡:
①HSO3– + H2O H2SO3 + OH– 和 ② (写出离子方程式)
H2SO3 + OH– 和 ② (写出离子方程式)
向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
a.加入少量金属Na,平衡①如何移动? 溶液的pH如何变化?
b.加入氨水至中性,则式子:c(Na+) = c(SO32–)+ c(HSO3–)+ c(H2SO3)>c(H+) = c(OH–),是否正确 ,解释原因 。
(1)2I-+2NO2-+4H+=I2+2NO+2H2O 2e
(2)氯气、浓硝酸、酸性高锰酸钾氧化性太强,还能继续氧化I2
(3)碘在水中溶解度不大,且易升华 水浴加热
(4)富集碘元素
(5)HSO3– 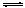 H++SO32-
H++SO32-
逆向移动, pH值升高
正确,物料守恒
解析试题分析:(1)根据氧化还原原理:离子方程式2I-+2NO2-+4H+=I2+2NO+2H2O,碘失电子给氮,转移电子 2e-。
(2)主要是氯气、浓硝酸、酸性高锰酸钾氧化性太强,还能继续氧化I2。
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体。解释产生这种现象的原因碘在水中溶解度不大,且易升华,所以,反应②需要在水浴加热条件下进行。
(4)流程中,碘元素经过了I2→I-、IO3-→I2的变化过程,这样反复的原因是富集碘元素。
(5)流程中用到的NaHSO3溶液显弱酸性,由于亚硫酸的电离产生,离子方程式为HSO3– 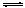 H++SO32-。a.加入少量金属Na,钠与水生成了氢氧化钠,溶液中氢氧根浓度增大,平衡①向右移动,溶液的pH升高。b根据钠与硫的物料守恒关系,可知正确。
H++SO32-。a.加入少量金属Na,钠与水生成了氢氧化钠,溶液中氢氧根浓度增大,平衡①向右移动,溶液的pH升高。b根据钠与硫的物料守恒关系,可知正确。
考点:本题主要考查氧化还原反应的电子转移,实验原理分析,物料守恒关系的运用。

甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ +
 SO32- +
SO32- + =
= F e2+ +
F e2+ + +
+

乙同学查阅资料得知:
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| III | 向1 mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
硫酸厂用煅烧黄铁矿(FeS2)制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2制备绿矾。
(一)SO2和O2反应制取的反应原理为:2SO2+O2 2SO3,在一密闭容器中一定时间内达到平衡。
2SO3,在一密闭容器中一定时间内达到平衡。
(1)该反应的平衡常数表达式为______。
(2)该反应达到平衡状态的标志是______。
| A.v(SO2)=v(SO3) | B.混合物的平均相对分子质量不变 |
| C.混合气体质量不变 | D.各组分的体积分数不变 |
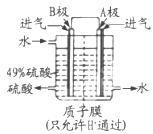
(3)B电极的电极反应式为______;溶液中H+的移动方向由______极到______极;电池总反应式为______。
(三)利用烧渣制绿矾的过程如下

测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL。溶液。
b.量取25 ml。待测液于锥形瓶中。
c.用硫酸酸化的0. 01 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL。根据上述步骤同答下列问题。
(4)滴定时发生反应的离子方程式为(完成并配平离子反应方程式)。

(5)用硫酸酸化的KMnO4滴定终点的标志是
(6)计算上述产品中的FeSO4.7H2O质量分数为______。