题目内容
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时v正(O2)=![]() v逆(NO)
v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
【答案】D
【解析】
本题主要考查化学平衡的影响因素。
A.![]() 为可逆反应,不能完全转化;
为可逆反应,不能完全转化;
B.平衡时,不同物质的正逆反应速率之比等于化学计量数之比;
C.该反应为气体体积增大的反应,则降低压强,平衡正向移动;
D.该反应为放热反应,升高温度,平衡逆向移动。
A. 为可逆反应,不能完全转化,则4molNH3和5molO2反应,达到平衡时放出热量小于905.9kJ,故A错误;
B. 平衡时,不同物质的正逆反应速率之比等于化学计量数之比,则平衡时5v正(O2)=4v逆(NO),故B错误;
C. 该反应为气体体积增大的反应,则降低压强,平衡正向移动,气体的物质的量增大,由M=![]() 可知,混合气体平均摩尔质量减小,故C错误;
可知,混合气体平均摩尔质量减小,故C错误;
D. 该反应为放热反应,升高温度,平衡逆向移动,则混合气体中NO含量降低,故D正确;
故选D。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照以下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2%H2O2溶液 | 无 |
② | 10mL5%H2O2溶液 | 无 |
③ | 10mL5%H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是___。
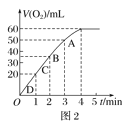
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1。分析图1能够得出的实验结论是__。
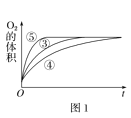
(3)加入0.1gMnO2粉末于50mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示。反应速率变化的原因是__。