题目内容
【题目】某同学利用如图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
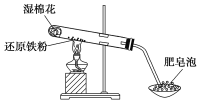
(1)试管中发生反应的化学方程式为______________________________________________。
(2)该同学欲确定反应一段时间后试管中固体物质的成分,设计了如下方案:
①待试管冷却,取其中固体少许溶于稀盐酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红,则试管中固体是________(只有一个选项符合题意),若溶液未变红,则试管中固体是________(只有一个选项符合题意)。
A.一定有Fe3O4,可能有Fe
B.只有Fe(OH)3
C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(3)该同学按上述方案进行了实验,溶液未变红色,原因是________________________________(用化学方程式表示)。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2AC2FeCl3+Fe===3FeCl2
Fe3O4+4H2AC2FeCl3+Fe===3FeCl2
【解析】
(1)铁粉与水蒸气反应产物为四氧化三铁和氢气;(2)四氧化三铁中有+2价的铁和+3价的铁,KSCN溶液溶液变红色,说明有三价铁离子;还有可能有过量的铁;若溶液未变红,过量的铁,可能将三价铁离子全部转化成二价铁离子;(3)铁单质能将三价铁离子还原成二价铁离子;
(1)Fe在加热条件下可与H2O(g)反应生成Fe3O4和H2。3Fe+4H2O(g)![]() Fe3O4+4H2 。(2)铁和水蒸气反应,产物为四氧化三铁和氢气,反应后试管中固体物质一定有Fe3O4,还可能有没反应完全的铁粉,取少许其中的固体物质溶于稀盐酸后,滴加KSCN溶液,若溶液变红色则说明试管中固体物质的成分一定含Fe3O4;若溶液未变红色,是因为固体物质中既含Fe3O4又含Fe,溶于盐酸后发生反应Fe+2Fe3+═2Fe2+,导致Fe3+被还原,溶液才未变红色,故选:A;C;(3)结果溶液未变红色,原因是加入稀盐酸时发生反应:2FeCl3+Fe═3FeCl2
Fe3O4+4H2 。(2)铁和水蒸气反应,产物为四氧化三铁和氢气,反应后试管中固体物质一定有Fe3O4,还可能有没反应完全的铁粉,取少许其中的固体物质溶于稀盐酸后,滴加KSCN溶液,若溶液变红色则说明试管中固体物质的成分一定含Fe3O4;若溶液未变红色,是因为固体物质中既含Fe3O4又含Fe,溶于盐酸后发生反应Fe+2Fe3+═2Fe2+,导致Fe3+被还原,溶液才未变红色,故选:A;C;(3)结果溶液未变红色,原因是加入稀盐酸时发生反应:2FeCl3+Fe═3FeCl2