题目内容
15.高铁酸盐钠(Na2FeO4)具有很强的氧化性,能有效杀灭水中的病菌和病毒.高铁酸盐钠属于( )| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
分析 电离出的阳离子全部是氢离子的化合物为酸;
电离出的阴离子全部是氢氧根离子的化合物为碱;
阳离子为金属离子或铵根离子,阴离子为酸根离子的化合物为盐;
由两种元素构成,其中一种为氧元素的化合物为氧化物,据此分析.
解答 解:高铁酸盐钠(Na2FeO4)的阳离子为金属离子,阴离子为酸根离子,根据定义可知,其属于盐,故选C.
点评 本题考查了酸碱盐和氧化物的概念,难度不大,根据定义来分析是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列反应中氧化剂和还原剂的物质的量之比为1:2的是( )
| A. | 铜和浓硝酸反应 | B. | 工业合成氨的反应 | ||
| C. | 工业制粗硅的反应 | D. | 铜和浓硫酸反应 |
6.化学与人类生产、生活,社会可持续发展密切相关.下列说法正确的是( )
| A. | 蔬菜表面洒少许福尔马林,可保鲜和消毒 | |
| B. | 绿色食品就是不使用化肥农药,不含任何化学物质的食品 | |
| C. | 光催化水制氢比电解水制氢更节能环保 | |
| D. | 光化学烟雾不会引起呼吸道疾病 |
3.下列溶液中NO${\;}_{3}^{-}$的物质的量浓度最大的是( )
| A. | 50 mL 1 mol•L-1的KNO3溶液 | B. | 50 mL 1 mol•L-1的Fe(NO3)3 | ||
| C. | 1 L 0.5 mol•L-1的Mg(NO3)2溶液 | D. | 1 L 0.5 mol•L-1的Ba(NO3)2溶液 |
10.下列有机物命名正确的是( )
| A. | 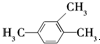 三甲苯 三甲苯 | B. |  2甲基2氯丙烷 2甲基2氯丙烷 | C. |  2甲基1丙醇 | D. | 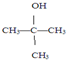 2-甲基-2丙醇 |
20.短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,D单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
| A. | 元素A的原子核外有2个电子 | |
| B. | 工业上常用电解C的盐溶液的方法制备元素C的单质 | |
| C. | 在所有非金属的氢化物中,元素E的气态氢化物最稳定 | |
| D. | 元素C的最高价氧化物对应的水化物的碱性比D的强 |
4.下列氧化物按其水化物的酸性由弱到强的顺序排列的是( )
| A. | SiO2<P2O5<Cl2O7<SO3 | B. | SiO2<P2O5<SO3<Cl2O7 | ||
| C. | P2O5<SiO2<SO3<Cl2O7 | D. | P2O5<SO3<Cl2O7<SiO2 |
 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.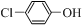 )的废水可以通过构成微生物电池除去,其原理如图所示.①B是电池的负极(填“正”或“负”);②A极的电极反应式为
)的废水可以通过构成微生物电池除去,其原理如图所示.①B是电池的负极(填“正”或“负”);②A极的电极反应式为 -OH+Cl-.
-OH+Cl-.