题目内容
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO2和H2可直接合成甲醇,向一密闭容器中充入CO2和H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①保持温度、体积一定,能说明上述反应达到平衡状态的是____。
A.容器内压强不变 B.3v正(CH3OH)= v正(H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
②测得不同温度时CH3OH的物质的量随时间的变化如图1所示,则ΔH____0(填“>”或“<”)。
(2)工业生产中需对空气中的CO进行监测。
①PdCl2溶液可以检验空气中少量的CO。当空气中含CO时,溶液中会产生黑色的Pd沉淀。若反应中有0.02 mol电子转移,则生成Pd沉淀的质量为______。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图2所示。这种传感器利用了原电池原理,则该电池的负极反应式为______。
(3)某催化剂可将CO2和CH4转化成乙酸。催化剂的催化效率和乙酸的生成速率随温度的变化关系如图3所示。乙酸的生成速率主要取决于温度影响的范围是______。
(4)常温下,将一定量的CO2通入石灰乳中充分反应,达平衡后,溶液的pH为11,则c(![]() )=____。(已知:Ksp[Ca(OH)2]=5.6×106,Ksp(CaCO3) =2.8×109)
)=____。(已知:Ksp[Ca(OH)2]=5.6×106,Ksp(CaCO3) =2.8×109)
(5)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。图4是通过光电转化原理以廉价原料制备新产品的示意图。催化剂a、b之间连接导线上电子流动方向是____(填“a→b”或“b→a”)。
【答案】AD < 1.06 g CO+4OH2eCO32-+2H2O 300℃~400℃ 5×1010 mol·L1 a→b
【解析】
(1)①反应前后气体分子数不相同,容器内压强不变意味着气体分子数不发生变化,反应到达平衡,A正确;
v正(CH3OH)=3v正(H2),表示的是同一方向反应速率,不能说明达到平衡状态,B错误;
密度等于质量除以容器体积,反应体系质量保持不变,容器体积固定,容器内气体的密度不变,不能说明达到平衡状态,C错误;
CO2是反应物,H2O为生成物,两者的物质的量之比保持不变能够说明达到平衡状态,D正确。
②温度高先达到平衡,但达平衡后,温度越高,CH3OH物质的量越小,平衡向逆反应进行,则正反应为放热反应,即ΔH<0。
(2)①若空气中含CO,则溶液中会产生黑色的Pd沉淀。依据PdCl2~Pd~2e,每转移2 mol电子,生成106 g Pd沉淀,0.02 mol电子转移,生成沉淀的质量=0.02 mol×106 g·mol1/2=1.06 g。
②测定一氧化碳气体含量,使一氧化碳发生氧化还原反应生成二氧化碳,原电池的负极是失电子发生氧化反应,碱性介质中负极电极反应为:CO+4OH2eCO32-+2H2O。
(3)由图知,乙酸的生成速率在300℃后逐渐增大,催化剂已失去活性,则乙酸的生成速率主要取决于温度影响的范围:300 ℃~400 ℃。
(4) 将少量CO2气体通入石灰乳中充分反应,c2(OH)/c(![]() )=c2(OH)×c(Ca2+)/c(
)=c2(OH)×c(Ca2+)/c(![]() )×c(Ca2+)=
)×c(Ca2+)=
Ksp[Ca(OH)2]/Ksp(CaCO3),此时c(OH)=1×103 mol·L1,则c(![]() )=
)=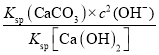 =
=
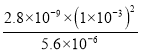 mol·L1=5×1010 mol·L1。
mol·L1=5×1010 mol·L1。
(5)由图可知,左室投入水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,a、b 之间导线上的电子流动方向是a→b。

 名校课堂系列答案
名校课堂系列答案【题目】(1)严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 |
15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是____(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
(2)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)某温度,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
①若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________v(逆)(填“>”“<”或“=”)。在其他条件不变的情况下,再增加2 mol CO与5 mol H2,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”)。
②下列不能说明该反应已达到平衡状态的是________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
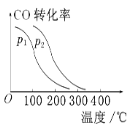
③在一定压强下,容积为V L的容器充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则p1________p2(填“大于”“小于”或“等于”,下同),ΔH________0。