题目内容
1.军用光敏材料KxFe(C2O4)y•3H2O(Fe元素的化合价为+3)的实验室制备和组成测定的方法如下:
Ⅰ.实验室制备
(1)用K2C2O4和FeCl3制备该光敏材料的反应属于①②(填序号).
①离子反应 ②非氧化还原反应 ③氧化还原反应 ④化合反应
(2)结晶时应将饱和溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(3)操作5包括:过滤、洗涤和干燥.
Ⅱ.组成测定
称取一定质量实验所得的晶体于锥形瓶中,加足量蒸馏水和稀硫酸,将C2O42-完全转化为H2C2O4,用0.10mol•L-1酸性KMnO4溶液进行滴定,消耗酸性KMnO4溶液24.00mL时恰好反应完全(酸性条件下MnO4-的还原物是Mn2+);再加入适量的还原剂,将Fe3+完全转化为Fe2+,用酸性KMnO4溶液继续滴定,当Fe2+完全氧化时,用去酸性KMnO4溶液4.00mL.
(4)KMnO4溶液氧化Fe2+的离子方程式是MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
(5)配制100mL 0.10mol•L-1酸性KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外,还有100ml容量瓶和酸式滴定管(填名称).
(6)通过计算,该光敏材料的化学式是K3Fe(C2O4)3•3H2O.
分析 用K2C2O4和FeCl3制备该光敏材料,用K2C2O4和FeCl3溶解蒸发,冷却结晶,过滤洗涤得到得到晶体,为析出晶体更纯净,需要进行重结晶,溶解过滤洗涤和干燥得到光敏材料KxFe(C2O4)y•3H2O;
Ⅰ、(1)光敏材料KxFe(C2O4)y•3H2O中Fe元素的化合价为+3价,用碳元素化合价为+3价,K2C2O4和FeCl3制备该光敏材料的反应过程中也是化合价未变化,故两种电解质在溶液中进行的反应属于非氧化还原反应、离子反应;
(2)由题目信息可知,化合物KxFe(C2O4)y•zH2O(Fe为+3价)是一种光敏感材料,推知黑暗是为了防止晶体见光分解;
(3)重结晶后必须经过过滤、洗涤和干燥,才能获得纯净的晶体;
Ⅱ、(4)高锰酸钾溶液具有强氧化性在酸性溶液中氧化亚铁离子为铁离子,高锰酸钾被还原为锰离子,结合原子守恒和电荷守恒配平书写离子方程式;
(5)题目中明确说道包含物质的量溶液配制和滴定实验,所以需要容量瓶和滴定管,关键是要准确写出“100mL容量瓶”,而KMnO4溶液有强氧化性,需用酸式滴定管盛放;
(6)由MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可知,n(Fe3+)=5n(MnO4-),由2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O可知n(C2O42-)=$\frac{5}{2}$n(MnO4-),根据化学式,可求得y的值,根据化合价代数和为0计算x的值,据此书写化学式.
解答 解:Ⅰ、(1)因为光敏材料KxFe(C2O4)y•3H2O中的Fe为+3价,即反应前后没有化合价变化,故两种电解质在溶液中进行的反应属于非氧化还原反应、离子反应,故选①②,
故答案为:①②;
(2)由题目信息可知,化合物KxFe(C2O4)y•zH2O(Fe为+3价)是一种光敏感材料,推知黑暗是为了防止晶体见光分解.
故答案为:黑暗可以防止晶体分解;
(3)重结晶后必须经过过滤、洗涤和干燥,才能获得纯净的晶体,操作5包括过滤、洗涤和干燥,
故答案为:过滤、洗涤和干燥;
Ⅱ、(4)KMnO4溶液氧化Fe2+的离子方程式是MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
(5)配制100mL 0.10mol•L-1KMnO4溶液,依据已有的仪器可知,还需要100mL容量瓶,所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外,滴定实验还需要滴定管,KMnO4溶液有强氧化性,可以发生橡皮管,需用酸式滴定管盛放,
故答案为:250mL容量瓶、酸式滴定管;
(6)由MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可知,n(Fe3+)=5n(MnO4-)=5×0.004L×0.10mol•L-1=0.002mol,由2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O可知,n(C2O42-)=$\frac{5}{2}$n(MnO4-)=$\frac{5}{2}$×0.024L×0.10mol•L-1=0.006mol,所以0.002mol:0.006mol=1:y,解得y=3,根据化合价代数和为0可知,x+3+3×(-2)=0,解得x=3,化合物KxFe(C2O4)y•3H2O,故该化合物的化学式为K3Fe(C2O4)3•3H2O.
故答案为:K3Fe(C2O4)3•3H2O.
点评 考查学生对工艺流程理解、阅读获取信息能力、溶液配制、氧化还原反应滴定与计算等,难度中等,需要学生具备阅读分析能力和灵活运用知识的解决问题能力.

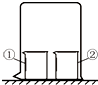 用图所示装置进行下列实验,实验结果与预测现象不一致的是( )
用图所示装置进行下列实验,实验结果与预测现象不一致的是( )| 选项 | ①中物质 | ②中物质 | 预测现象 |
| A | 酚酞溶液 | 浓氨水 | ①中无色变红色 |
| B | CCl4 | 液溴 | ①中变橙色 |
| C | 浓氨水 | 浓硫酸 | 空气中产生白烟 |
| D | NaAlO2溶液 | 浓盐酸 | ①中有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能肯定 |
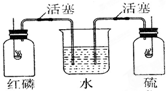 如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )
如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )| A. | 水迅速进入甲瓶和乙瓶 | B. | 水不进入甲瓶和乙瓶 | ||
| C. | 水只能进入甲瓶而不能进入乙瓶 | D. | 水只能进入乙瓶而不能进入甲瓶 |
| 选项 | 实验操作 | 实验现象 | 绪论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液NO3-被Fe2+还原为NO2 |
| B | 溴乙烷中加入氢氧化钠溶液加热充分反应后,滴入硝酸银溶液 | 产生浅黄色沉淀 | 溴乙烷中含有溴元素 |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向含有硫酸钡沉淀的溶液加入浓碳酸钠溶液,充分搅拌后过滤、洗涤,在滤渣中加入盐酸 | 产生无色无味气体 | Ksp(BaSO4)>Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
| A. | 25℃时,0.1mol•L-1HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中没有沉淀产生 | |
| D. | 该体系中有CaF2产生沉淀 |
| A. | 石炭酸: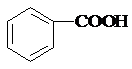 | B. | 甘油: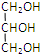 | C. | 蚁酸:CH3COOH | D. | 木精:CH3CH2OH |
| A. | 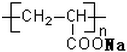 表示一种吸水性高分子树脂 表示一种吸水性高分子树脂 | |
| B. | 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 | |
| C. | 化合物 是苯的同系物 是苯的同系物 | |
| D. | 异丁烷的八氯代物共有4种(不考虑立体异构) |