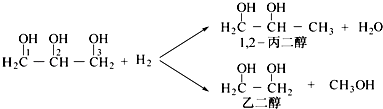
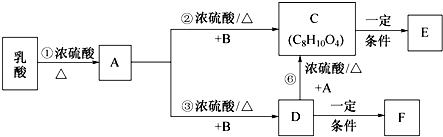
��Ŀ����
����Ŀ����������Ϊԭ�ϣ�ͨ��̼�Ȼ�ԭ���ɺϳɵ�������AlN����ͨ����ⷨ����ȡ���������ʱ����������CO2��ͨ��������̼���黯�����ã�
��ش�
��1����֪��2Al2O3��s���T4Al��g��+3O2��g����H1=3351KJmol��1
2C��s��+O2��g���T2CO��g����H2=��221KJmol��1
2Al��g��+N2��g���T2AlN��s����H3=��318KJmol��1
̼�Ȼ�ԭAl2O3�ϳ�AlN�����Ȼ�ѧ����ʽ��___________________________��
��2���ڳ�ѹ��Ru/TiO2���£�CO2��H2������壨�����1��4�������ʵ���a mol�����з�Ӧ�����CO2ת���ʡ�CH4��COѡ�������¶ȱ仯����ֱ���ͼ1��ͼ2��ʾ��ѡ���ԣ�ת����CO2������CH4��CO�İٷֱȣ���
��Ӧ��CO2��g��+4H2��g��![]() CH4��g��+2H2O��g����H4
CH4��g��+2H2O��g����H4
��Ӧ��CO2��g��+H2��g��![]() CO��g��+H2O��g����H5
CO��g��+H2O��g����H5

������˵������ȷ����_______
A����H4����
B���¶ȿ�Ӱ������ѡ����
C��CO2ƽ��ת�������¶���������������
D�������������䣬��CO2��H2�ij�ʼ����ȸı�Ϊ1��3�������CO2ƽ��ת����
��350��ʱ����Ӧ����t1ʱ�̴ﵽƽ�⣬ƽ��ʱ�������ΪVL���¶��·�Ӧ���ƽ�ⳣ��Ϊ______����a��V��ʾ��
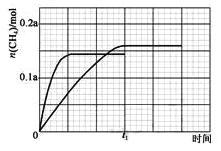
��350����CH4���ʵ�����ʱ��ı仯������ͼ3��ʾ������400����0��t1ʱ��CH4���ʵ�����ʱ��ı仯����_______��

��3�������ױ�����CO2�����ڼ���ˮ��Һ�е�����ɼ��飬���ɼ���ĵ缫��Ӧʽ��_______��
���𰸡� 3C��s��+Al2O3��s��+N2��g��=2AlN��s��+3CO��g����H=+1026KJ/mol/L CD ![]()
 CO2+6H2O+8e���TCH4+8OH��
CO2+6H2O+8e���TCH4+8OH��
��������(1)��֪����2Al2O3(s)===4Al(g)��3O2(g)����H1��3 351 kJ��mol��1����2C(s)��O2(g)===2CO(g)����H2����221 kJ��mol��1����2Al(g)��N2(g)===2AlN(s)����H3����318 kJ��mol��1�����ݸ�˹���ɢ١�![]() ���ڡ�
���ڡ�![]() ���ۼ��õ�̼�Ȼ�ԭAl2O3�ϳ�AlN�����Ȼ�ѧ����ʽ��3C(s)��Al2O3(s)��N2(g)===2AlN(s)��3CO(g)����H����H1��
���ۼ��õ�̼�Ȼ�ԭAl2O3�ϳ�AlN�����Ȼ�ѧ����ʽ��3C(s)��Al2O3(s)��N2(g)===2AlN(s)��3CO(g)����H����H1��![]() ����H2��
����H2��![]() ����H3=+1026 kJ��mol��1��
����H3=+1026 kJ��mol��1��
��2����A��ͼ1�У�������̼ת�����������Ƿ�Ӧ������У���һ���¶ȴﵽƽ��״̬������ƽ�������ƶ���������̼��ת���ʳ��¶����߶���С��˵������ӦΪ���ȷ�Ӧ����H4��0��ѡ��A��ȷ��B��ͼ2������֪��ͼ�����߱仯�������¶����ߵ�400�����ϣ�CH4��COѡ�������¶�Ӱ�죬������٣�һ����̼���࣬�¶ȿ�Ӱ������ѡ���ԣ�ѡ��B��ȷ��C��������̼ת�����������Ƿ�Ӧ�������δ�ﵽƽ��״̬���ﵽƽ��״̬�����¶����߶�����̼ת���ʼ�С��ѡ��C����D��CO2��H2������壨�����1��4�������ʵ���a mol�����з�Ӧ����CO2��H2�ij�ʼ����ȸı�Ϊ1��3��������̼��ת���ʼ�С��ѡ��D����ѡCD�����ڳ�ѹ��Ru/TiO2���£�CO2��H2������壨�����1��4�������ʵ���a mol�����з�Ӧ��350��ʱ����Ӧ����t1ʱ�̴ﵽƽ�⣬ƽ��ʱ�������ΪVL��������̼��ת����Ϊ80%�� CO2��g��+4H2��g��![]() CH4��g��+2H2O��g��
CH4��g��+2H2O��g��
��ʼ��(mol) 0.2a 0.8a 0 0
�仯��(mol) 0.16a 0.64a 0.16a 0.32a
ƽ����(mol) 0.04a 0.16a 0.16a 0.32a
��Ӧ���ƽ�ⳣ��K=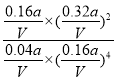 =
=![]() ���۷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���������̼��ת���ʼ�С����ͼ������֪���ӽ�72.5%����������ʵ�����С��С��350��ʱ��������ʵ������ﵽƽ������Ҫʱ������
���۷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���������̼��ת���ʼ�С����ͼ������֪���ӽ�72.5%����������ʵ�����С��С��350��ʱ��������ʵ������ﵽƽ������Ҫʱ������
CO2��g��+4H2��g��![]() CH4��g��+2H2O��g��
CH4��g��+2H2O��g��
��ʼ��(mol) 0.2a 0.8a 0 0
�仯��(mol) 0.145a 0.58a 0.145a 0.29a
ƽ����(mol) 0.055a 0.22a 0.145a 0.29a
����ͼ�ﵽƽ��״̬����0.145amol�������¶ȼӿ췴Ӧ���ʣ��ﵽƽ������Ҫʱ�����̣��õ�ͼ��Ϊ��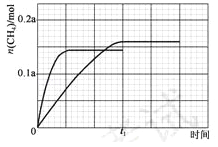 ����3��CO2�����ڼ���ˮ��Һ�е�����ɼ��飬��ϵ���غ��ԭ���غ���ƽ���У����ɼ���ĵ缫��ӦʽΪ��CO2+6H2O+8e���TCH4+8OH����
����3��CO2�����ڼ���ˮ��Һ�е�����ɼ��飬��ϵ���غ��ԭ���غ���ƽ���У����ɼ���ĵ缫��ӦʽΪ��CO2+6H2O+8e���TCH4+8OH����

 ��У����ϵ�д�
��У����ϵ�д�