题目内容
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、NaHCO3溶液中存在:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
| B、室温下,向0.01mol?L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| C、Na2CO3溶液:c(OH-)+c(HCO3-)=c(H+)+2c(H2CO3) |
| D、25℃时,Al(OH)3固体在20mL 0.01mol/L氨水中的Ksp比在20mL 0.01mol/LNH4Cl溶液中的Ksp小 |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.碳酸根离子带有两个单位的负电荷,其系数应该为2;
B.溶液为中性,则c(OH-)=c(H+),根据电荷守恒可得c(Na+)+c(NH4+)=c(SO42-),铵根离子部分水解,则c(SO42-)>c(NH4+);
C.水电离出的氢离子与氢氧根离子浓度相等,根据碳酸钠溶液中的质子守恒进行判断;
D.氨水为碱性溶液,氢氧根离子抑制了氢氧化铝的溶解,而氯化铵为酸性溶液,氢离子促进了氢氧化铝的溶解.
B.溶液为中性,则c(OH-)=c(H+),根据电荷守恒可得c(Na+)+c(NH4+)=c(SO42-),铵根离子部分水解,则c(SO42-)>c(NH4+);
C.水电离出的氢离子与氢氧根离子浓度相等,根据碳酸钠溶液中的质子守恒进行判断;
D.氨水为碱性溶液,氢氧根离子抑制了氢氧化铝的溶解,而氯化铵为酸性溶液,氢离子促进了氢氧化铝的溶解.
解答:
解:A.碳酸根离子带有2个单位负电荷,NaHCO3溶液中的电荷守恒为:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-),故A错误;
B.室温下,向0.01mol?L-1 NH4HSO4溶液中滴加NaOH溶液至中性,则c(OH-)=c(H+),根据电荷守恒可得c(Na+)+c(NH4+)=c(SO42-),铵根离子部分水解,则c(SO42-)>c(NH4+),所以溶液中离子浓度大小关系为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故B正确;
C.碳酸钠溶液中,水电离的氢离子与氢氧根离子浓度相等,根据质子守恒可得:c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-),故C错误;
D.氢氧化铝的溶解平衡为:Al(OH)3(s)?Al3+(aq)+3OH-(aq),氨水中氢氧根离子抑制了氢氧化铝的溶解,氯化铵溶液显示酸性,溶液中的氢离子促进了氢氧化铝的溶解,所以相同温度下,Al(OH)3固体在20mL 0.01mol/L氨水中的Ksp比在20mL 0.01mol/LNH4Cl溶液中的Ksp大,故D错误;
故选B.
B.室温下,向0.01mol?L-1 NH4HSO4溶液中滴加NaOH溶液至中性,则c(OH-)=c(H+),根据电荷守恒可得c(Na+)+c(NH4+)=c(SO42-),铵根离子部分水解,则c(SO42-)>c(NH4+),所以溶液中离子浓度大小关系为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故B正确;
C.碳酸钠溶液中,水电离的氢离子与氢氧根离子浓度相等,根据质子守恒可得:c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-),故C错误;
D.氢氧化铝的溶解平衡为:Al(OH)3(s)?Al3+(aq)+3OH-(aq),氨水中氢氧根离子抑制了氢氧化铝的溶解,氯化铵溶液显示酸性,溶液中的氢离子促进了氢氧化铝的溶解,所以相同温度下,Al(OH)3固体在20mL 0.01mol/L氨水中的Ksp比在20mL 0.01mol/LNH4Cl溶液中的Ksp大,故D错误;
故选B.
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握比较溶液中离子浓度大小的方法,注意电荷守恒、物料守恒、质子守恒等在比较离子浓度大小中的应用,明确难溶物的溶解平衡及其影响因素.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
常温下,下列各组离子在指定的溶液中可能大量共存的是( )
| A、无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- |
| B、含大量Fe3+的溶液中:K+、I-、SO42-、NO3- |
| C、与Al反应放出H2的溶液中:NH4+、Na+、NO3-、F- |
| D、由水电离出的c(H+)=1.0×10-14mol/L的溶液中:Mg2+、K+、Cl-、SO42- |
W、Z、Y、X四种短周期元素的原子序数依次减少.W、Z位于同周期,原子半径Z大于W;Z、W的最高正价之和等于X的最高正价;W的质子数等于X、Y的质子数之和;W的最高价氧化物对应的水化物与Z、Y的最高价氧化物对应的水化物均能发生反应.下列说法中不正确的是( )
| A、气态氢化物的稳定性:X<Y |
| B、没有X元素也就没有丰富的有机世界 |
| C、非金属性Y>X,金属性W>Z |
| D、在一定条件下,利用X、Z或W单质的还原性,可以冶炼某些金属 |
在下列分子中,能够在同一个平面内的原子数最多的是( )
| A、甲烷 |
| B、一溴甲烷(CH3Br) |
| C、乙烯 |
| D、CH2=CH-C≡CH |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、0.1mol/L MgCl2溶液中Cl-离子数为0.2NA |
| B、19.2g铜与足量的稀硝酸反应产生NO的体积为4.48L |
| C、标准状况下,33.6L H2O含有9.03×1023个H2O分子 |
| D、46g NO2和N2O4的混合物中原子总数为3NA个 |
已知维生素A的结构简式如图.关于它的叙述正确的是( )
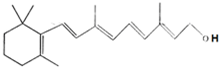

| A、维生素A的分子式为C20H30O |
| B、维生素A是一种易溶于水的醇 |
| C、维生素A分子中含有羟基、碳碳双键和苯环等官能团 |
| D、1mol维生素A最多可与7mol H2发生加成反应 |
50mL物质的量浓度为18mol/L的硫酸中加入足量铜片并加热,充分反应,下列有关说法中正确的是( )
| A、有0.9mol的硫酸参加反应 |
| B、有0.45mol的硫酸被还原 |
| C、充分反应后体系无硫酸剩余 |
| D、消耗的铜的质量一定少于28.8g |
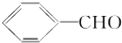
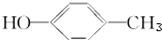
 的物质互为同分异构体的是( )
的物质互为同分异构体的是( )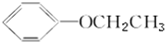

 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: