题目内容
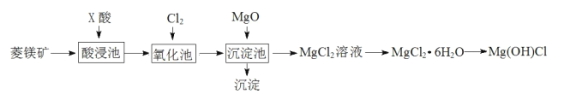
【题目】某同学利用菱镁矿(主要含MgCO3,FeCO3杂质)制取碱式氯化镁[Mg(OH)Cl]的流程。已知:MgO用于调节沉淀池中溶液的pH值。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Mg2+ | 8.8 | 11.4 |
下列说法不正确的是( )
A.酸浸池中加入的![]() 酸可以是硫酸
酸可以是硫酸
B.加入MgO后的沉淀一定含有Fe(OH)3
C.氧化池中通入氯气的目的是将Fe2+氧化为Fe3+
D.制得碱式氯化镁的方程式为:MgCl2·6H2O![]() Mg(OH)Cl+HCl↑+5H2O↑
Mg(OH)Cl+HCl↑+5H2O↑
【答案】A
【解析】
菱镁矿中含有MgCO3和FeCO3,加入过量的酸溶解,根据流程目的是制取Mg(OH)Cl,因此X酸为盐酸,通入氯气将Fe2+氧化成Fe3+,再加MgO调节pH,得到氢氧化铁沉淀,过滤分离后,得到MgCl2溶液,据此分析解答。
A.通过菱镁矿制取Mg(OH)Cl,X酸应是盐酸,如果加入硫酸,引入新杂质SO42-,故A说法错误;
B.菱镁矿中除含有MgCO3外,还含有FeCO3,流程制取Mg(OH)Cl,需要将Fe2+除去,根据流程,通入氯气,将Fe2+氧化成Fe3+,再加入MgO,调节pH,使Fe元素以Fe(OH)3沉淀而除去,故B说法正确;
C.根据流程,FeCO3与盐酸反应,生成FeCl2、CO2,再通入氯气,利用氯气的氧化性将Fe2+氧化成Fe3+,故C说法正确;
D.根据流程,获得Mg(OH)Cl,反应方程式为MgCl2·6H2O![]() Mg(OH)Cl+HCl↑+5H2O↑,故D说法正确;
Mg(OH)Cl+HCl↑+5H2O↑,故D说法正确;
答案:A。

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目