题目内容
一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:
2NO2(红棕色) N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答
2NO2(红棕色)
 N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答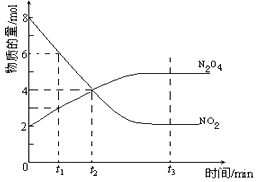
(1)在该温度下,反应的化学平衡常数表达式为:_______________
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率:_________mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?____________________
(4)t1时,正反应速率______(填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向______移动 (填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色___________(填“变深”、“变浅”或“不变”)
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率:_________mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?____________________
(4)t1时,正反应速率______(填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向______移动 (填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色___________(填“变深”、“变浅”或“不变”)
(1)
(2)0.1
(3)t3
(4)>
(5)正反应应方向
(6)变深

(2)0.1
(3)t3
(4)>
(5)正反应应方向
(6)变深

练习册系列答案
相关题目
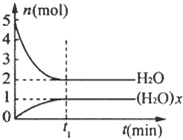 一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g)?(H2O)x(g),反应物和生成物的物质的量随时间变化关系如图.下列说法不正确的是( )
一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g)?(H2O)x(g),反应物和生成物的物质的量随时间变化关系如图.下列说法不正确的是( )| A、x=3 | ||
| B、该温度下,反应的平衡常数为0.125L3/mol3 | ||
| C、平衡时混合气体的平均摩尔质量是33.3g/mol | ||
D、t1时刻,保持温度不变,再充入1mol H2O(g),重新达到平衡时,
|
在一定温度下,在容积为10L的密闭容器中,用2molCO和10molH2O(气)相互混合并加热到800℃时,有下列平衡:CO+H2O?CO2+H2,且平衡常数K=1,则有CO的转化率为( )
| A、16.7% | B、50% | C、66.7% | D、83.3% |
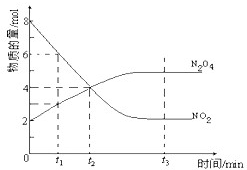 一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)?N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)?N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答: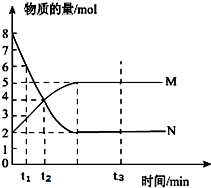 一定温度下,在容积为V L的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示: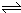 M
M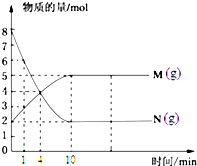 一定温度下,在容积为100L的定容密闭容器中进行某化学反应,反应体系中各组分的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为100L的定容密闭容器中进行某化学反应,反应体系中各组分的物质的量随时间的变化曲线如图所示: