题目内容
在一定温度下,在容积为10L的密闭容器中,用2molCO和10molH2O(气)相互混合并加热到800℃时,有下列平衡:CO+H2O?CO2+H2,且平衡常数K=1,则有CO的转化率为( )
| A、16.7% | B、50% | C、66.7% | D、83.3% |
分析:依据化学平衡的三段式列式计算,结合平衡常数表达式计算消耗的一氧化碳的物质的量,结合转化率概念计算得到;
解答:解:在一定温度下,在容积为10L的密闭容器中,用2molCO和10molH2O(气)相互混合并加热到800℃时,有下列平衡:CO+H2O?CO2+H2,且平衡常数K=1;设一氧化碳消耗浓度为x
CO+H2O?CO2 +H2
起始量(mol/L) 0.2 1 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 0.2-x 1-x x x
K=
=1
计算得到x=
mol/L
一氧化碳的转化率=
×100%=83.3%;
故选D.
CO+H2O?CO2 +H2
起始量(mol/L) 0.2 1 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 0.2-x 1-x x x
K=
| x2 |
| (0.2-x)(1-x) |
计算得到x=
| 1 |
| 6 |
一氧化碳的转化率=
| ||
| 0.2mol |
故选D.
点评:本题考查了化学平衡的计算应用,主要是平衡常数和转化率概念的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
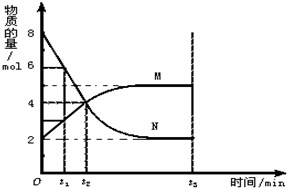 在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题:
在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题: M
M 目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.