题目内容
12.20℃时,将10mL 0.1mol/L Na2S2O3溶液和10mL 0.1mol/L的H2SO4溶液混合,3min后溶液中明显出现浑浊.已知温度每升高10℃,化学反应速度增大到原来的3倍,那么40℃时,同样的反应要同样看到浑浊,需要的时间是( )| A. | 40s | B. | 15s | C. | 30s | D. | 20s |
分析 已知温度每升高10℃,化学反应速率增大到原来的3倍,那么40℃时,温度升高20℃,反应速率应是10℃的32=9倍,反应需要时间为原先的$\frac{1}{9}$,以此解答该题.
解答 解:化学反应中,升高温度,反应速率增大,10℃时将0.1mol/L Na2S2O3溶液10mL和0.1mol/L的硫酸10mL溶液混合,2min后溶液中出现混浊,即10s;
已知温度每升高10℃,化学反应速率增大到原来的3倍,那么40℃时,温度升高了20℃,反应速率应是10℃的32=9倍,
则同样的反应出现混浊需要的时间为:$\frac{180}{9}$s=20s,
故选D.
点评 本题考查化学反应速率的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握温度升高后速率的变化倍数,为解答该题的关键,难度中等.

练习册系列答案
相关题目
15.某无色溶液中加入氢氧化铝固体,氢氧化铝迅速溶解,则该溶液中一定能够大量共存的离子组是( )
| A. | K+、Ba2+、NO3-、Cl- | B. | Na+、NH4+、SO42-、HCO3- | ||
| C. | Ca2+、K+、SO32-、NO3- | D. | Na+、K+、Cu2+、Br- |
20.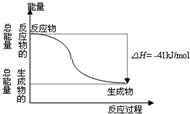 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )| A. | 1mol CO2(g)和1mol H2(g)反应生成1molCO(g)和1mol H2O(g)要放出41kJ热量 | |
| B. | 该反应为放热反应 | |
| C. | 反应的热化学方程式是:CO(g)+H2O (g)=CO2(g)+H2(g)△H=+41kJ/mol | |
| D. | CO(g)与H2O(g)所具有的总能量小于CO2(g)与H2(g)所具有的总能量 |
7.某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是( )
| A. | K+、Ca2+、HCO3-、Cl- | B. | Na+、K+、Cl-、SO42- | ||
| C. | NH4+、K+、Cl-、SO32- | D. | K+、Cl-、NO3-、SO42- |
17.(Ⅰ)观察图A、B、C,回答下列问题:
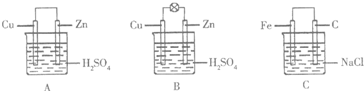
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片没有(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为2H++2e-=H2↑.
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol/L、c(ZnSO4)=1mol/L.
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式O2+2H2O+4e-=4OH-.
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是温度升高H2O2的分解速率加快,导致H2O2的浓度降低从而使铜的溶解速率慢.

(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片没有(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为2H++2e-=H2↑.
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol/L、c(ZnSO4)=1mol/L.
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式O2+2H2O+4e-=4OH-.
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
4.下列实验操作正确的是( )
| A. | 实验室制乙烯:将乙醇和浓H2SO4按1:3(体积比)混合(放碎瓷片),迅速升温至140℃ | |
| B. | 实验室制硝基苯:试剂顺序--先加浓H2SO4,再加浓HNO3混合冷却后,最后加苯 | |
| C. | 检验卤代烃消去反应的有机产物:1-溴丙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别矿物油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
1.下列说法正确的是( )
| A. | 氯化氢溶于水的过程属于放热反应 | |
| B. | 有化学键断裂的过程一定属于化学反应 | |
| C. | 物质导电的过程一定是物理变化 | |
| D. | 同分异构体之间的相互转化一定是化学变化 |
2.下列说法正确的是( )
| A. | 具有共价键的化合物就是共价化合物 | |
| B. | 离子化合物不可能全部由非金属构成 | |
| C. | H2O比H2S的沸点高是由于H2O中的O-H键更牢固 | |
| D. | 寻找半导体材料可以在元素周期表的金属与非金属的分界线附近寻找 |
 .
.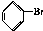 与Br2,要想得到纯净的产物,可用NaOH溶液或水试剂洗涤.
与Br2,要想得到纯净的产物,可用NaOH溶液或水试剂洗涤.