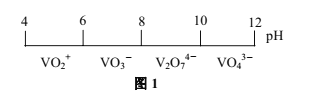
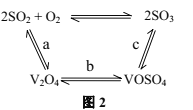
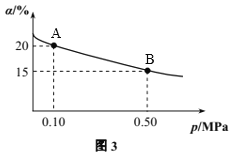
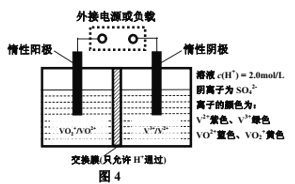
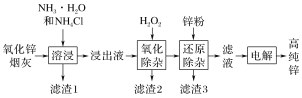
题目内容
【题目】亚硝酰硫酸![]() 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用![]() 和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
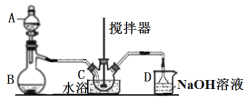
(1)仪器B的名称____________。
(2)B中产生SO2,其化学方程式为_______________________________________。
(3)三颈烧瓶C中浓硝酸与![]() 在浓硫酸作用下反应制得
在浓硫酸作用下反应制得![]()
①实验前浓硝酸和浓硫酸混合的操作为______________________________________。
②C中反应温度不能太高的原因为___________________________________。
③用冷水浴维持C温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,其原因可能是______________________。
后,反应明显加快,其原因可能是______________________。
(4)测定产品的纯度
准确称取1.5g产品放入锥形瓶中,加入![]() 、100.00mL的
、100.00mL的![]() 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知:![]()
①草酸钠与高锰酸钾溶液反应的离子方程式为__________________________________。
②滴定终点的现象为______________________________________________。
③亚硝酰硫酸的纯度![]() ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
【答案】蒸馏烧瓶 Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ 将浓硫酸缓缓加入浓硝酸,边加边搅拌 温度太高,浓硝酸会挥发和分解 生成的![]() 作为该反应的催化剂 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O 滴入最后一滴
作为该反应的催化剂 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O 滴入最后一滴![]() 溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复 84.67%
溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复 84.67%
【解析】
(1)仪器B的名称为蒸馏烧瓶。
(2)B中为固体与液体反应产生SO2,所以应为亚硫酸钠与硫酸反应。
(3)①实验前浓硝酸和浓硫酸混合的操作,类似于浓硫酸稀释。
②C中反应温度不能太高,主要从浓硝酸的性质进行分析。
③温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,应考虑可能是催化作用。
后,反应明显加快,应考虑可能是催化作用。
(4) ①草酸钠与高锰酸钾溶液反应,生成Mn2+、CO2和H2O。
②滴定终点时,起初为浅紫色,则后来为无色。
③先利用草酸钠求出过量KMnO4的物质的量,再求出与![]() 反应的KMnO4的物质的量,从而求出亚硝酰硫酸的纯度。
反应的KMnO4的物质的量,从而求出亚硝酰硫酸的纯度。
(1)仪器B的名称蒸馏烧瓶。答案为:蒸馏烧瓶;
(2)B中Na2SO3与H2SO4反应生成SO2,其化学方程式为Na2SO3+H2SO4
=Na2SO4+H2O+SO2↑。答案为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
(3)①实验前浓硝酸和浓硫酸混合,相当于浓硫酸稀释,其操作为将浓硫酸缓缓加入浓硝酸中,边加边搅拌。答案为:将浓硫酸缓缓加入浓硝酸中,边加边搅拌;
②C中反应温度不能太高的原因为温度太高,浓硝酸会挥发和分解。答案为:温度太高,浓硝酸会挥发和分解;
③用冷水浴维持C温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,其原因可能是生成的
后,反应明显加快,其原因可能是生成的![]() 作为该反应的催化剂。答案为:生成的
作为该反应的催化剂。答案为:生成的![]() 作为该反应的催化剂;
作为该反应的催化剂;
(4)①草酸钠与高锰酸钾溶液反应的离子方程式为2MnO4-+5C2O42-+16H+
=2Mn2++10CO2↑+8H2O。答案为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
②滴定终点的现象为滴入最后一滴![]() 溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复。答案为:滴入最后一滴
溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复。答案为:滴入最后一滴![]() 溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复;
溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复;
③设与C2O42-反应的MnO4-的物质的量为x

从而求出x=0.006mol,则与![]() 反应的KMnO4物质的量为0.01mol-0.006mol
反应的KMnO4物质的量为0.01mol-0.006mol
=0.004mol。
设![]() 的物质的量为y
的物质的量为y

从而求出y=0.01mol,亚硝酰硫酸的纯度![]()
![]() =84.67%。答案为:84.67%。
=84.67%。答案为:84.67%。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去,查阅资料可知: 常温下,部分阳离子以氢氧化物形式沉淀时溶液的 pH 如下表:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的 pH | 1.9 | 7.0 | 4.3 |
沉淀完全的 pH | 3.2 | 9.0 | 5.6 |
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原 Cr(VI)。下列关于铁屑的说法中正确的是______________(填字母序号)。
a.作原电池的正极 b.在反应中作还原剂 c.铁屑生成 Fe3+可以进一步还原![]()
II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。装置如下图所示。
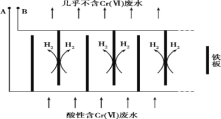
(2)B极连接电源的___________极;
(3)电解开始时,B 极上主要发生的电极反应为2H++2e-= H2↑,此外还有少量![]() 在B极上直接放电,该反应的电极反应式为 _______________。
在B极上直接放电,该反应的电极反应式为 _______________。
(4)①酸性环境可以促使![]() 到
到![]() 的转化,写出对应的离子方程式:__________________;
的转化,写出对应的离子方程式:__________________;
②写出酸性环境中 Fe2+还原![]() 的离子方程式_______________________。
的离子方程式_______________________。