题目内容
|
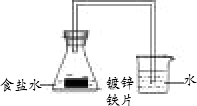
某课外活动小组,为了研究金属的腐蚀和防护原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图所示装置进行实验,过一段时间后观察,下列现象不可能出现的是
| |
| [ ] | |
A. |
烧杯中导气管内产生气泡 |
B. |
烧杯中导气管里形成一段水柱 |
C. |
金属片剪口变红 |
D. |
锌被腐蚀 |
答案:A
解析:
解析:
|
铁-锌- NaCl溶液构成原电池,溶液显中性,锌比铁活泼,因此锌作负极,铁作正极,发生的电极反应分别是:Zn-2e- |

练习册系列答案
相关题目
 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
 ,请在方框内写出导致该阶段颜色变化的粒子符号.
,请在方框内写出导致该阶段颜色变化的粒子符号.
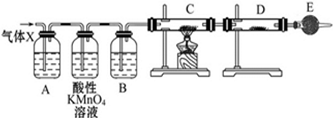 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,有同学认为产生的气体除SO2外,还可能产生氢气.该同学为了检验他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去).试回答:
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,有同学认为产生的气体除SO2外,还可能产生氢气.该同学为了检验他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去).试回答: