题目内容
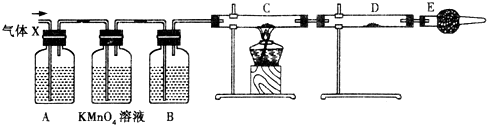
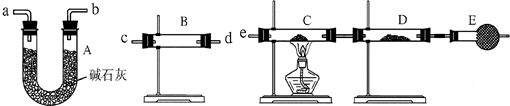
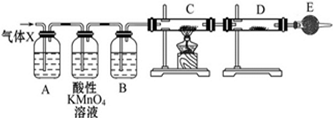 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,有同学认为产生的气体除SO2外,还可能产生氢气.该同学为了检验他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去).试回答:
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,有同学认为产生的气体除SO2外,还可能产生氢气.该同学为了检验他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去).试回答:(1)A中加入的试剂可能是
(2)上述反应中生成二氧化硫的化学方程式为
(3)如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?
(4)可以证明气体X中含有氢气的实验现象是:C中
分析:(1)装置A的作用为检验气体X中有二氧化硫,通常使用品红溶液;E装置的碱石灰吸收空气中的水蒸气,避免干扰实验检验结果;装置A、B之间的高锰酸钾溶液用于除去气体X中的二氧化硫;
(2)Zn与浓H2SO4反应生成硫酸锌、二氧化硫和水,据此书写化学方程式;
(3)B装置的作用是吸收水,防止后面的氢气的检验;
(4)氢气和氧化铜反应生成铜和水,水和无水硫酸铜反应生成蓝色的五水硫酸铜.
(2)Zn与浓H2SO4反应生成硫酸锌、二氧化硫和水,据此书写化学方程式;
(3)B装置的作用是吸收水,防止后面的氢气的检验;
(4)氢气和氧化铜反应生成铜和水,水和无水硫酸铜反应生成蓝色的五水硫酸铜.
解答:解:(1)A装置的作用是检验二氧化硫的存在,二氧化硫能漂白品红,所以通过品红溶液褪色检验SO2的存在,现象是品红褪色;碱石灰的主要成分为氧化钙和氢氧化钠,能吸收水和二氧化碳,为防止空气中的水蒸气进入D中;A、B装置之间的酸性高锰酸钾溶液用于除去气体X中的二氧化硫气体,
故答案为:品红溶液;检验气体X中是否含有SO2;防止空气中的水蒸气进入D中,干扰检验;除去气体X中的SO2;
(2)浓硫酸具有强氧化性,金属锌具有还原性,Zn与浓H2SO4反应生成硫酸锌、二氧化硫和水,反应的方程式为:Zn+2H2S4 (浓)
ZnSO4+SO2↑+2H2O,
故答案为:Zn+2H2S4 (浓)
ZnSO4+SO2↑+2H2O;
(3)锌和硫酸反应生成的气体中必含有水,如果去掉装置B,因为混合气体中含有的H2O会干扰H2的检验,
故答案为:不能;因为混合气体中可能含有H2O会干扰H2的检验;
(4)为了检验氢气的存在,氢气与氧化铜在加热条件下反应生成铜和水,该反应的化学方程式为:H2+CuO
Cu+H2O黑色CuO变成红色的Cu,需用无水硫酸铜检验氢气被氧化的产物水,水和无水硫酸铜反应生成蓝色的五水合硫酸铜,所以可以证明气体X中含有H2的实验现象是C中黑色CuO变成红色的Cu;D中白色粉末变成蓝色,
故答案为:黑色粉末(CuO)变成红色光亮的物质;白色粉末变成蓝色晶体.
故答案为:品红溶液;检验气体X中是否含有SO2;防止空气中的水蒸气进入D中,干扰检验;除去气体X中的SO2;
(2)浓硫酸具有强氧化性,金属锌具有还原性,Zn与浓H2SO4反应生成硫酸锌、二氧化硫和水,反应的方程式为:Zn+2H2S4 (浓)
| ||
故答案为:Zn+2H2S4 (浓)
| ||
(3)锌和硫酸反应生成的气体中必含有水,如果去掉装置B,因为混合气体中含有的H2O会干扰H2的检验,
故答案为:不能;因为混合气体中可能含有H2O会干扰H2的检验;
(4)为了检验氢气的存在,氢气与氧化铜在加热条件下反应生成铜和水,该反应的化学方程式为:H2+CuO
| ||
故答案为:黑色粉末(CuO)变成红色光亮的物质;白色粉末变成蓝色晶体.
点评:本题考查锌和硫酸的反应及产物的检验,题目难度中等,注意掌握浓硫酸的性质,根据需检验气体的性质、检验方法理解检验的先后顺序是解答的关键.

练习册系列答案
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目