题目内容
【题目】铬鞣剂[Cr(OH)SO4]可用于提高皮革的耐曲折强度。一种以铬渣(含Cr2O3及少量Fe2O3、CaO、Al2O3、SiO2等杂质)为原料制备Cr(OH)SO4的工艺流程如图:

回答下列问题:
(1)“焙烧”时发生的主要的化学方程式为__。
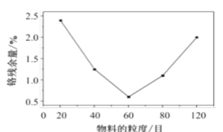
(2)“水浸”过程中,物料的粒度(颗粒大小)对铬残余量的影响如图所示,则最佳反应条件为__。
(3)“滤渣2”主要成分为Al(OH)3和__(填化学式),“过滤2”后,将溶液pH调至a(a小于6.5),发生的离子反应为__,若1L所得溶液中含铬元素的质量为28.6g,![]() 有
有![]() 转化为
转化为![]() 。酸化后所得溶液中c(
。酸化后所得溶液中c(![]() )=__。
)=__。
(4)根据有关国家标准,含![]() 的废水要经化学处理,使其浓度降至5.0×107mol·L1以下才能排放。含
的废水要经化学处理,使其浓度降至5.0×107mol·L1以下才能排放。含![]() 的废水处理通常可用沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×1010],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__mol·L1,后续废水处理方能达到国家排放标准。
的废水处理通常可用沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×1010],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__mol·L1,后续废水处理方能达到国家排放标准。
(5)已知CH3OH在酸性条件下可被氧化生成CO2,写出Na2Cr2O7与CH3OH反应生成Cr(OH)SO4的化学方程式__。
(6)某厂用m1kg的铬渣(含Cr2O340%)制备Cr(OH)SO4,最终得到产品m2kg,则产率为__。
【答案】2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2 物质的粒度为60目 H2SiO3 2
4Na2CrO4+4CO2 物质的粒度为60目 H2SiO3 2![]() +2H+
+2H+![]() +H2O 0.25mol·L1 2.4×104 Na2Cr2O7+CH3OH+3H2SO4=2Cr(OH)SO4+CO2↑+Na2SO4+4H2O
+H2O 0.25mol·L1 2.4×104 Na2Cr2O7+CH3OH+3H2SO4=2Cr(OH)SO4+CO2↑+Na2SO4+4H2O ![]()
【解析】
由流程可知,铬渣加入纯碱、空气和辅料氧化煅烧,Cr2O3转化为Na2CrO4,存在的副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑,且水浸之后滤渣1中还原氧化铁和氢氧化钙,加入稀硫酸调节pH,除去溶液中的AlO2-、SiO32-,则滤渣2为氢氧化铝、硅酸;滤液中存在2
2NaAlO2+CO2↑,且水浸之后滤渣1中还原氧化铁和氢氧化钙,加入稀硫酸调节pH,除去溶液中的AlO2-、SiO32-,则滤渣2为氢氧化铝、硅酸;滤液中存在2![]() +2H+
+2H+![]() +H2O,经调节pH=a、蒸发结晶后可生成重铬酸钠,然后加入甲醇、硫酸将重铬酸钠还原为Cr(OH)SO4,据此分析解答。
+H2O,经调节pH=a、蒸发结晶后可生成重铬酸钠,然后加入甲醇、硫酸将重铬酸钠还原为Cr(OH)SO4,据此分析解答。
(1)“焙烧”时Cr2O3转化为Na2CrO4,反应化学方程式是2Cr2O3+4Na2CO3+3O2 ![]() 4Na2CrO4+4CO2,故答案为:2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4CO2,故答案为:2Cr2O3+4Na2CO3+3O2 ![]() 4Na2CrO4+4CO2;
4Na2CrO4+4CO2;
(2)由图可知,“水浸”过程中,物料的粒度(颗粒大小)为60目时铬残余量最小,则最佳的反应条件为60目,故答案为:物质的粒度为60目;
(3)“滤渣2”的主要成分为Al(OH)3和H2SiO3,“过滤2”后,将溶液pH调至a,a小于6.5,目的是使![]() 转化为
转化为![]() +H2O,酸化时发生的反应为:2
+H2O,酸化时发生的反应为:2![]() +2H+
+2H+![]() +H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,
+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,![]() 有转化为
有转化为![]() ,说明铬元素有
,说明铬元素有![]() 转化为
转化为![]() ,根据铬元素守恒,存在关系式:2Cr~2
,根据铬元素守恒,存在关系式:2Cr~2![]() ~
~![]() ,n(
,n(![]() )剩余=
)剩余=![]() ×
×![]() =0.05mol,则n(
=0.05mol,则n(![]() )=0.25mol,因此酸化后所得溶液中c(
)=0.25mol,因此酸化后所得溶液中c(![]() )=
)=![]() =0.25molL-1,故答案为:H2SiO3;2
=0.25molL-1,故答案为:H2SiO3;2![]() +2H+
+2H+![]() +H2O;0.25molL-1;
+H2O;0.25molL-1;
(4)根据沉淀溶解平衡BaCrO4![]() +Ba2+,有Ksp(BaCrO4)=c(
+Ba2+,有Ksp(BaCrO4)=c(![]() )×c(Ba2+) =1.2×10-10=5.0×10-7×c(Ba2+),解得:c(Ba2+)=2.4×10-4mol/L,故答案为:2.4×10-4;
)×c(Ba2+) =1.2×10-10=5.0×10-7×c(Ba2+),解得:c(Ba2+)=2.4×10-4mol/L,故答案为:2.4×10-4;
(5)CH3OH被氧化生成CO2,根据流程图,Na2Cr2O7被还原为Cr(OH)SO4,反应的化学方程式为Na2Cr2O7+3H2SO4+CH3OH=2Cr(OH)SO4+Na2SO4+CO2↑+4H2O,故答案为:Na2Cr2O7+3H2SO4+CH3OH=2Cr(OH)SO4+Na2SO4+CO2↑+4H2O;
(6)用m1kg的铬渣(含Cr2O340%)制备Cr(OH)SO4,最终得到产品m2kg,由Cr原子守恒可知理论上生成产品的质量为![]() ×165g/mol×2kg=
×165g/mol×2kg=![]() kg,则产率为
kg,则产率为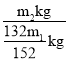 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

【题目】下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | H | |||||||
2 | C | N | F | Ne | ||||
3 | Na | Mg | Al | S | Cl |
(1)金属性最强的元素是______(填元素符号)。
(2)最不活泼元素的原子结构示意图为________。
(3)第3周期元素中,其最高价氧化物对应得水化物具有两性得元素是______(填元素名称)。
(4)Na、Mg两种元素中,原子半径较大的是______。
(5)第3周期中,某元素的一种氧化物是形成酸雨的主要物质,该氧化物的化学式为_______。
(6)工业上可以用Cl2和H2来制取盐酸该反应的方程式为_______________________________。
(7)HF与HCl热稳定性较强的是_________。
(8)由碳与氢元素形成的最简单有机物的化学式为_____,该物质中碳元素与氢元素的质量比为_________,其分子空间构型为_____________。
(9)重氢![]() 和超重氢
和超重氢![]() 两种核素都可用作制造氢弹的原料,它们所含中子数之比为____。
两种核素都可用作制造氢弹的原料,它们所含中子数之比为____。

