题目内容
在
 和
和 的混合溶液中,加入足量的
的混合溶液中,加入足量的 的溶液,生成
的溶液,生成 沉淀,再加入足量
沉淀,再加入足量 溶液并加热,生成
溶液并加热,生成 (标准状况),则原溶液中
(标准状况),则原溶液中 的浓度为
的浓度为
A.  B.
B.
 C.
C.
 D.
D. 
【答案】
B
【解析】9.32g沉淀是硫酸钡,物质的量是9.32g÷233g/mol=0.04mol,所以SO42-的物质的量是0.04mol。氨气是0.448L÷22.4L/mol=0.02mol,则NH4+的物质的量是0.02mol。因此根据电荷守恒可知,溶液中Al3+的浓度是(0.04mol×2-0.02mol)÷3=0.02mol,因此浓度是0.02ml÷0.1L=0.2molL,答案选B。

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
电子产品产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
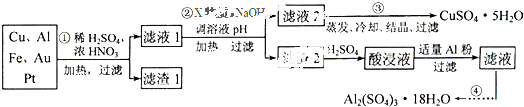
按要求回答下列问题:
(1)滤渣1中存在的金属有 .
(2)已知沉淀物的pH如下表:
①则操作②中X物质最好选用的是 (填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是 .
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是 .
(4)用一个离子方程式表示在酸浸液中加入足量铝粉的反应: .
(5)由CuSO4?5H2O制备CuSO4时,应把CuSO4?5H2O放在 (填仪器名称)中加热脱水.
(6)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是 (填序号)
A.Ksp(CuCO3)<Ksp(CaCO3) B.c(Cu2+)<c(Ca2+)
C.
>
D.
<
.

按要求回答下列问题:
(1)滤渣1中存在的金属有
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是
(4)用一个离子方程式表示在酸浸液中加入足量铝粉的反应:
(5)由CuSO4?5H2O制备CuSO4时,应把CuSO4?5H2O放在
(6)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是
A.Ksp(CuCO3)<Ksp(CaCO3) B.c(Cu2+)<c(Ca2+)
C.
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
下列说法中正确是( )
| A、蔗糖和葡萄糖互为同分异构体 | B、淀粉、纤维素都是天然高分子化合物 | C、在常温下,淀粉遇碘离子变蓝 | D、检验蔗糖在稀H2SO4作用下水解的产物,可在水解后的混合溶液中直接加新制Cu(OH)2,加热观察有无砖红色沉淀 |