题目内容
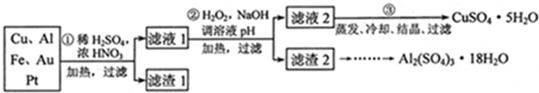
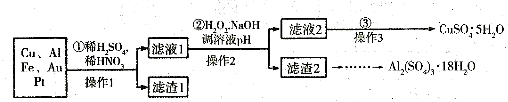
电子产品产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: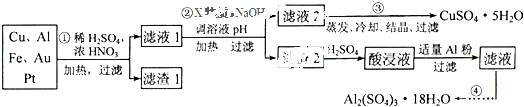
按要求回答下列问题:
(1)滤渣1中存在的金属有
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是
(4)用一个离子方程式表示在酸浸液中加入足量铝粉的反应:
(5)由CuSO4?5H2O制备CuSO4时,应把CuSO4?5H2O放在
(6)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是
A.Ksp(CuCO3)<Ksp(CaCO3) B.c(Cu2+)<c(Ca2+)
C.
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
分析:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生了反应,所以滤渣1的成分是Pt和Au;
(2)①根据双氧水具有氧化性且被还原为水,产物无杂质无污染进行分析;
②依据流程分析,加入氧化剂后亚铁离子被氧化为铁离子,加入氢氧化钠调节溶液PH使铁离子和铝离子全部沉淀,铜离子不沉淀,据此判断pH的范围;
(3)根据检验铁离子、亚铁离子的方法进行解答,注意先检验铁离子,再检验亚铁离子;
(4)滤渣2为氢氧化铁和氢氧化铝的混合物,加入酸溶液后生成了铁离子、铝离子,向该溶液中加入铝粉,铁离子与铝反应生成铁和铝离子,据此写出反应的离子方程式;
(5)加热硫酸铜晶体时需要放在坩埚中进行;
(6)先生成CuCO3沉淀,说明溶液中铜离子生成碳酸铜沉淀需要的碳酸根离子浓度
小于钙离子生成碳酸钙沉淀需要的碳酸根离子浓度
,据此进行解答.
(2)①根据双氧水具有氧化性且被还原为水,产物无杂质无污染进行分析;
②依据流程分析,加入氧化剂后亚铁离子被氧化为铁离子,加入氢氧化钠调节溶液PH使铁离子和铝离子全部沉淀,铜离子不沉淀,据此判断pH的范围;
(3)根据检验铁离子、亚铁离子的方法进行解答,注意先检验铁离子,再检验亚铁离子;
(4)滤渣2为氢氧化铁和氢氧化铝的混合物,加入酸溶液后生成了铁离子、铝离子,向该溶液中加入铝粉,铁离子与铝反应生成铁和铝离子,据此写出反应的离子方程式;
(5)加热硫酸铜晶体时需要放在坩埚中进行;
(6)先生成CuCO3沉淀,说明溶液中铜离子生成碳酸铜沉淀需要的碳酸根离子浓度
| Ksp(CuCO3) |
| c(Cu2+) |
| Ksp(CaCO3) |
| c(Ca2+) |
解答:解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,Au、Pt和酸不反应,所以滤渣是Au、Pt,故答案为:Au、Pt;
(2)①第②步加入试剂X的作用是将Fe2+氧化为Fe3+,双氧水与亚铁离子的反应为:2Fe2++H2O2+2H+=2Fe3++2H2O,双氧水做氧化剂被还原后为水,不引入杂质,对环境无污染,而高锰酸钾溶液、漂白粉、氯气做氧化剂,反应后引进了装置,且污染环境,所以试剂X最好选用双氧水,
故答案为:d;
②调溶液PH的目的是使Fe3+和Al3+形成沉淀,依据图表数据分析可知,铁离子完全沉淀时溶液pH=3.7,铝离子完全沉淀时溶液pH=4.4,而铜离子开始沉淀时的pH=4.9,所以使Fe3+和Al3+形成沉淀,铜离子不沉淀,溶液pH调节范围应该为:4.4<pH<4.9,
故答案为:4.4<pH<4.9;
(3)检验滤液2中既不存在Fe2+又不存在Fe3+,可以先取少量滤液,向溶液中加入硫氰化钾溶液,如果溶液没有变成红色,证明溶液中不存在铁离子,然后向溶液中滴入新制的氯水,如果溶液没有变成红色,证明不存在亚铁离子,
故答案为:取少量滤液于试管中,向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,继续向溶液中滴入新制氯水,如果溶液不变红证明不存在Fe2+;
(4)根据实验流程,酸浸液中含有铁离子和铝离子,向酸浸液中加入铝粉后,铁离子与铝发生反应生成铁和铝离子,反应的离子方程式为Fe3++Al=Al3++Fe,
故答案为:Fe3++Al=Al3++Fe;
(5)由CuSO4?5H2O制备CuSO4时,应把CuSO4?5H2O放在坩埚中,故答案为:坩埚;
(6)碳酸铜、碳酸钙的溶度积分别为:Ksp(CuCO3)=c(Cu2+)?c(CO32-)、Ksp(CaCO3)=c(Ca2+)?c(CO32-),向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,说明铜离子生成碳酸铜沉淀需要的碳酸根离子浓度小于钙离子生成碳酸钙沉淀需要的碳酸根离子,即
<
,整理得:
>
,
故答案为:C.
(2)①第②步加入试剂X的作用是将Fe2+氧化为Fe3+,双氧水与亚铁离子的反应为:2Fe2++H2O2+2H+=2Fe3++2H2O,双氧水做氧化剂被还原后为水,不引入杂质,对环境无污染,而高锰酸钾溶液、漂白粉、氯气做氧化剂,反应后引进了装置,且污染环境,所以试剂X最好选用双氧水,
故答案为:d;
②调溶液PH的目的是使Fe3+和Al3+形成沉淀,依据图表数据分析可知,铁离子完全沉淀时溶液pH=3.7,铝离子完全沉淀时溶液pH=4.4,而铜离子开始沉淀时的pH=4.9,所以使Fe3+和Al3+形成沉淀,铜离子不沉淀,溶液pH调节范围应该为:4.4<pH<4.9,
故答案为:4.4<pH<4.9;
(3)检验滤液2中既不存在Fe2+又不存在Fe3+,可以先取少量滤液,向溶液中加入硫氰化钾溶液,如果溶液没有变成红色,证明溶液中不存在铁离子,然后向溶液中滴入新制的氯水,如果溶液没有变成红色,证明不存在亚铁离子,
故答案为:取少量滤液于试管中,向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,继续向溶液中滴入新制氯水,如果溶液不变红证明不存在Fe2+;
(4)根据实验流程,酸浸液中含有铁离子和铝离子,向酸浸液中加入铝粉后,铁离子与铝发生反应生成铁和铝离子,反应的离子方程式为Fe3++Al=Al3++Fe,
故答案为:Fe3++Al=Al3++Fe;
(5)由CuSO4?5H2O制备CuSO4时,应把CuSO4?5H2O放在坩埚中,故答案为:坩埚;
(6)碳酸铜、碳酸钙的溶度积分别为:Ksp(CuCO3)=c(Cu2+)?c(CO32-)、Ksp(CaCO3)=c(Ca2+)?c(CO32-),向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,说明铜离子生成碳酸铜沉淀需要的碳酸根离子浓度小于钙离子生成碳酸钙沉淀需要的碳酸根离子,即
| Ksp(CuCO3) |
| c(Cu2+) |
| Ksp(CaCO3) |
| c(Ca2+) |
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
故答案为:C.
点评:本题考查了硫酸铝、硫酸铜的制备、难溶物溶解平衡及沉淀转化的本质,题目难度较大,合理分析题中制备流程及制取原理是解题根据,(6)为难点、易错点,注意相同类型的难溶物,其溶度积越小,溶解度越小.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
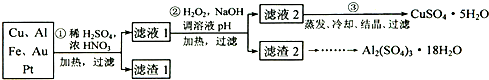
电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
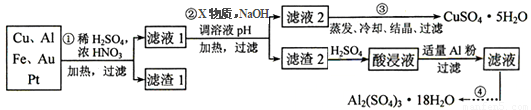
按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.7 |
|
Cu2+ |
4.9 |
6.7 |
|
Al3+ |
3.0 |
4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。