题目内容
【题目】氮及其化合物在生产生活中用途广泛。请回答:
I.在微生物作用下,土壤中的NH4+最终被O2氧化为NO3-,该反应的离子方程式为________。
Ⅱ.氨气是重要的化工原料。已知:25℃时,NH3·H2O的电离常数kb=1.79×10-5,该温度下,1.79mol/LNH4Cl溶液的pH约为_____________。
Ⅲ.汽车在行驶过程中有如下反应发生:
ⅰ.N2(g)+O2(g)![]() 2NO(g) △H=+180.7kJ/mol
2NO(g) △H=+180.7kJ/mol
ⅱ.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.5kJ/mol
N2(g)+2CO2(g) △H=-746.5kJ/mol
(1)能表示CO燃烧热的热化学方程式为__________________。
(2)反应ⅱ在________(填“较高”或“较低”)温度下能自发进行。
(3)T温度时,向10L恒容密闭容器中充入2molNO和2molCO发生反应ii,5min时达到平衡,测得0~5min内该反应速率v(N2)=0.016mol·L-1·min-1。
①T温度时,该反应的平衡常数K=____________________。
②平衡时容器内压强与起始时容器内压强之比为_________________。
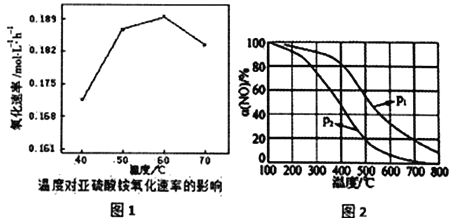
(4)一定条件下,向起始容积为5L的恒压密闭容器充入1molN2和1molO2发生反应i。O2的平衡转化率(α)与温度(T)的关系如图1所示;正反应的平衡常数(K)与温度(T)的关系如图2所示。
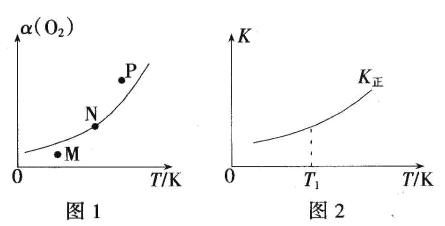
①图1中,M、N、P三点所对应的状态下,v(正)>v(逆)的是_______(填字母),理由为______。
②T1温度时,K正=1,则O2的平衡转化率为________(保留三位有效数字);在图2中画出逆反应平衡常数(K逆)与温度(T)的关系曲线。________
【答案】 NH4++2O2![]() NO3-+H2O+2H+ 4.5 CO(g)+
NO3-+H2O+2H+ 4.5 CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=-282.9 kJ·mol-1 较低 800 4:5 M 一定温度下,M点对应状态的O2的转化率小于其平衡转化率,反应正向进行建立平衡 33.3%
CO2(g) ΔH=-282.9 kJ·mol-1 较低 800 4:5 M 一定温度下,M点对应状态的O2的转化率小于其平衡转化率,反应正向进行建立平衡 33.3% 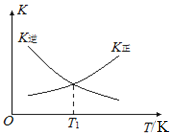
【解析】I.在微生物作用下,土壤中的NH4+最终被O2氧化为NO3-,反应的离子方程式为NH4++2O2![]() NO3-+H2O+2H+,故答案为:NH4++2O2
NO3-+H2O+2H+,故答案为:NH4++2O2![]() NO3-+H2O+2H+;
NO3-+H2O+2H+;
Ⅱ. 设该温度下,1.79mol/LNH4Cl溶液的pH为a,该溶液中氢离子浓度为1.0×10-amol/L,一水合氨的浓度约为1.0×10-amol/L,此时溶液中氢氧根离子浓度为: ![]() mol/L=1.0×10-(14-a)mol/L,由于水解程度较小,则铵根离子浓度约为1.79mol/L,则该温度下NH3H2O的电离常数约为:K=
mol/L=1.0×10-(14-a)mol/L,由于水解程度较小,则铵根离子浓度约为1.79mol/L,则该温度下NH3H2O的电离常数约为:K=![]() =1.79×10-5,解得:a=4.5,故答案为:4.5;
=1.79×10-5,解得:a=4.5,故答案为:4.5;
Ⅲ.(1)ⅰ.N2(g)+O2(g)![]() 2NO(g) △H=+180.7kJ/mol
2NO(g) △H=+180.7kJ/mol
ⅱ.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.5kJ/mol
N2(g)+2CO2(g) △H=-746.5kJ/mol
根据盖斯定律,将![]() ×(i+ii),得CO(g)+
×(i+ii),得CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=
CO2(g) ΔH=![]() ×(-746.5kJ/mol+180.7kJ/mol)=-282.9 kJ·mol-1,故答案为:CO(g)+
×(-746.5kJ/mol+180.7kJ/mol)=-282.9 kJ·mol-1,故答案为:CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=-282.9 kJ·mol-1;
CO2(g) ΔH=-282.9 kJ·mol-1;
(2)反应ⅱ的△H<0,△S<0,要反应能够自发进行,须△G=△H-T△S<0,因此在较低温度下能自发进行,故答案为:较低;
(3)①T温度时, 0~5min内该反应速率v(N2)=0.016mol·L-1·min-1,则平衡时c(N2)=0.016mol·L-1·min-1×5min=0.08mol/L,根据方程式2NO(g)+2CO(g)![]() N2(g)+2CO2(g),c(CO2) =0.16mol/L,c(CO) =0.04mol/L,c(CO2) =0.04mol/L,该反应的平衡常数K=
N2(g)+2CO2(g),c(CO2) =0.16mol/L,c(CO) =0.04mol/L,c(CO2) =0.04mol/L,该反应的平衡常数K=![]() =800,故答案为:800;
=800,故答案为:800;
②平衡时容器内压强与起始时容器内压强之比物质的量之比=![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(4)①图1中,一定温度下,M点对应状态的O2的转化率小于其平衡转化率,反应正向进行建立平衡,因此v(正)>v(逆)的是M点,故答案为:M;一定温度下,M点对应状态的O2的转化率小于其平衡转化率,反应正向进行建立平衡
② N2(g)+O2(g)![]() 2NO(g)
2NO(g)
起始(mol)1 1 0
反应 x x 2x
平衡 1-x 1-x 2x
K正=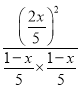 =1,解得:x=
=1,解得:x=![]() mol,O2的平衡转化率为
mol,O2的平衡转化率为![]() ×100%=33.3%,该反应逆反应是放热反应,升高温度,平衡正反应方向移动,K逆逐渐减小,逆反应平衡常数(K逆)与温度(T)的关系曲线为
×100%=33.3%,该反应逆反应是放热反应,升高温度,平衡正反应方向移动,K逆逐渐减小,逆反应平衡常数(K逆)与温度(T)的关系曲线为 ,故答案为:
,故答案为: 。
。

【题目】某同学配制480 mL 0.5 mol/L NaOH溶液。
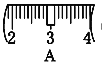
⑴ 该同学在实验过程中,用到的玻璃仪器有:量筒、玻璃棒、胶头滴管___________。
⑵ 其操作步骤如乙图所示,则甲图操作应在乙图中的____(填选项字母)之间。
A.①与② B.②与③ C.④与⑤ D.⑤与⑥


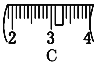
⑶ 该同学应称取NaOH固体___g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_____(填小写字母),
并在下图中选出能正确表示游码位置的选项____(填大写字母)。
附表:砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |

⑷ 该同学实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是____(填序号)。
A.称量NaOH固体时,采用了“左码右物” B.容量瓶中原来存有少量水
C.溶解固体的烧杯移液后未洗涤 D.用胶头滴管加水定容时仰视刻度
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)写出H2CO3的电离方程式:______________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是______________________(填宇母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH)
C. c(H+)·c(OH-) D. 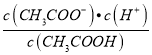
若该溶液升髙温度,上述4种表达式的数据增大的是_________________________。
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
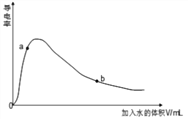
n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同, 则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余