题目内容
11.已知氮化铝的晶胞结构如图所示,下列说法正确的是( )
| A. | 氮化铝晶胞结构与NaCl相同 | B. | 第一电离能N<Al | ||
| C. | 电负性N>Al | D. | 原子半径N>Al |
分析 A.NaCl晶胞中,没有氯离子周围有6个钠离子,每个钠离子周围有6个氯离子;
B.元素非金属性越强,原子越不易失去电子,第一电离能越大;
C.非金属性越强,电负性越大;
D.同周期自左而右原子半径减小、同主族自上而下原子半径增大.
解答 解:A.NaCl晶胞中,没有氯离子周围有6个钠离子,每个钠离子周围有6个氯离子,AlN晶体中每个N原子周围有3个Al原子,二者晶胞结构不相同,故A错误;
B.元素非金属性越强,原子越不易失去电子,第一电离能越大,故第一电离能 N>Al,故B错误;
C.非金属性越强,电负性越大,故电负性N>Al,故C正确;
D.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径 N<Al,故D错误,
故选:C.
点评 本题是对物质结构的考查,涉及电负性、电离能、原子半径、晶体结构等,需要学生具备一定灵活运用基础知识的能力,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.将pH=4的酸性溶液与pH=10的NaOH溶液等体积混合后,溶液的pH可能是( )
| A. | 等于7 | B. | 大于7 | C. | 小于7 | D. | 无法确定 |
19.碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用.
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是SiO2+2NaOH═Na2SiO3+H2O(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是D.
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
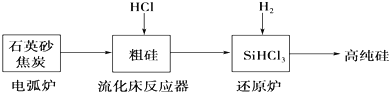
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
③SiHCl3极易水解,其完全水解的化学方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是SiO2+2NaOH═Na2SiO3+H2O(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是D.
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
16.常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长.
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
则元素Y第一电离能大于X的原因是Mg为3s2构型,完全充满状态,是一种稳定结构;
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②已知CN-与 N2结构相似,1mol CN-中π键数目为2NA.
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长.
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②已知CN-与 N2结构相似,1mol CN-中π键数目为2NA.
3.下列说法不正确的是( )
| A. | 二氧化氮会导致酸雨和光化学烟雾,危害较大 | |
| B. | 铝制品不宜用于盛放酸、碱溶液,不宜长时间盛放咸菜等腌制食品 | |
| C. | 人体中极少量的NO 会促进血管扩张,防止血管栓塞 | |
| D. | 利用铝热反应可实现工业制镁 |
 现有反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,如图表示反应Ⅱ在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,则图中t2时刻发生改变的条件可能是B.
现有反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,如图表示反应Ⅱ在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,则图中t2时刻发生改变的条件可能是B.