题目内容
【题目】为解决燃料危机和温室效应,科学家尝试用CO2与CH4制取CO和H2。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
②2H2(g)+CO(g)![]() CH3OH(1) ΔH2=-128.3kJ·mol-1
CH3OH(1) ΔH2=-128.3kJ·mol-1
③2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
④2CH4(g)+O2(g)![]() 2CH3OH(1) △H4
2CH3OH(1) △H4
在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇在低温下能否自发进行____(填“能”或“否”),理由是____。
(2)某温度下,CH4(g)+H2O(g)![]() CO(g)+3H2(g),将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=____(以k正、k逆表示)。若k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=____kPa·s-1(保留两位有效数字)。
CO(g)+3H2(g),将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=____(以k正、k逆表示)。若k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=____kPa·s-1(保留两位有效数字)。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。
CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。
一定条件下,按不同的投料比![]() 向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1____X2(填“>”或“<”,后同),Q____0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-)∶c(HCO3-)=____。
[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
②欲用5LNa2CO3溶液将23.3gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为____。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积的变化)
【答案】能 2CH4(g)+O2(g)![]() 2CH3OH(1) △H4=-328.0kJ·mol-1<0,根据方程式可判断反应的△S<0,故在低温时能自发进行
2CH3OH(1) △H4=-328.0kJ·mol-1<0,根据方程式可判断反应的△S<0,故在低温时能自发进行 ![]() 4.9×107 kPa·s-1 > < KA>KB=KC 1∶2 0.52mol/L
4.9×107 kPa·s-1 > < KA>KB=KC 1∶2 0.52mol/L
【解析】
(1)将①②③式作如下处理得到④式:①×2+②×2+③=④,所以△H4=2ΔH1+2ΔH2+ΔH3=2×(+206.1kJ·mol-1)-2×(-128.3kJ·mol-1)- 483.6kJ·mol-1=-328.2 kJ·mol-1,所以2CH4(g)+O2(g)![]() 2CH3OH(1)的△H<0,且该反应是气体分子数减少的反应,熵减,
2CH3OH(1)的△H<0,且该反应是气体分子数减少的反应,熵减,![]() <0,当ΔH-TΔS<0时,反应能自发进行,即T比较小的时候才能满足,所以低温时,能自发进行,故答案为:能;2CH4(g)+O2(g)
<0,当ΔH-TΔS<0时,反应能自发进行,即T比较小的时候才能满足,所以低温时,能自发进行,故答案为:能;2CH4(g)+O2(g)![]() 2CH3OH(1) △H4=-328.0kJ·mol-1<0,根据方程式可判断反应的△S<0,故在低温时能自发进行;
2CH3OH(1) △H4=-328.0kJ·mol-1<0,根据方程式可判断反应的△S<0,故在低温时能自发进行;
(2)因为正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),所以p(CH4)×p(H2O)=![]() ,p(CO)×p3(H2)=
,p(CO)×p3(H2)=![]() ,由CH4(g)+H2O(g)
,由CH4(g)+H2O(g)![]() CO(g)+3H2(g)可知,Kp=
CO(g)+3H2(g)可知,Kp=![]() =
=![]() =
=![]() ,平衡时:
,平衡时:![]()
![]() ,所以Kp=
,所以Kp=![]() ,将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,CH4分解20%时有
,将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,CH4分解20%时有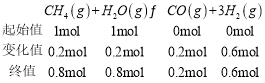 ,总压=100 kPa,所以CH4分解20%时p(CH4)=100 kPa×
,总压=100 kPa,所以CH4分解20%时p(CH4)=100 kPa×![]() =
=![]() kPa,p(H2O)= 100 kPa×
kPa,p(H2O)= 100 kPa×![]() =
=![]() kPa,v正=k正×p(CH4)×p(H2O)=4.4×104kPa-1·s-1×
kPa,v正=k正×p(CH4)×p(H2O)=4.4×104kPa-1·s-1×![]() kPa×
kPa×![]() kPa≈4.9×107 kPa·s-1,故答案为:
kPa≈4.9×107 kPa·s-1,故答案为:![]() ;4.9×107 kPa·s-1;
;4.9×107 kPa·s-1;
(3)①当其他条件一定时,充入的H2量越多,CO2转化率越高,对应的X越大,则X1>X2,在其它条件不变时,结合图象可知:温度升高,CO2的转化率降低,可推知该反应的正反应是放热反应,则Q<0,故答案为:﹥;﹤;
②结合图象可知该反应的正反应为放热反应,温度升高,平衡逆向移动,该反应的化学平衡常数减小,而且化学平衡常数只与温度有关,根据图象知A点的温度低于B、C两点,而且B、C两点温度相同,则三点对应的平衡常数的大小关系为:KA>KB=KC,故答案为:KA>KB=KC;
(4)①由题意pH=10,可计算c(H+)=1×1010mol/L,由HCO![]() CO
CO![]() +H+可得:Ka2=
+H+可得:Ka2=![]() =5×1011,所以
=5×1011,所以![]() =1∶2,故答案为:1∶2;
=1∶2,故答案为:1∶2;
②设至少需要物质的量浓度为xmol/L的Na2CO3溶液,当BaSO4完全溶解后,23.3gBaSO4的物质的量为n(BaSO4)=23.3g÷233g/mol=0.1mol,所得5L溶液中c(SO![]() )=0.1mol÷5L=0.02mol/L,此时溶液中c(CO
)=0.1mol÷5L=0.02mol/L,此时溶液中c(CO![]() )=(x-0.02)mol/L,由BaSO4+CO
)=(x-0.02)mol/L,由BaSO4+CO![]() =BaCO3+SO
=BaCO3+SO![]() 可知,此反应的化学平衡常数K=
可知,此反应的化学平衡常数K=![]() =0.04=
=0.04=![]() ;②设至少需要物质的量浓度为xmol/L的Na2CO3溶液,当BaSO4完全溶解后,所得5L溶液中c(SO
;②设至少需要物质的量浓度为xmol/L的Na2CO3溶液,当BaSO4完全溶解后,所得5L溶液中c(SO![]() )=0.02mol/L,此时溶液中c(CO
)=0.02mol/L,此时溶液中c(CO![]() )=(x-0.02)mol/L,由BaSO4+CO
)=(x-0.02)mol/L,由BaSO4+CO![]() =BaCO3+SO
=BaCO3+SO![]() 可知,此反应的化学平衡常数K=
可知,此反应的化学平衡常数K=![]() =0.04=
=0.04=![]() ,解得x=0.52mol/L,故答案为:0.52 mol/L。
,解得x=0.52mol/L,故答案为:0.52 mol/L。

 名校课堂系列答案
名校课堂系列答案