��Ŀ����
����Ŀ��a mol FeS��b mol FeOͶ�뵽VL cmol/L��������Һ�г�ַ�Ӧ������NO���壬���ó�����Һ�ɷֿɿ�����Fe(NO3)3��H2SO4�Ļ��Һ����Ӧ��δ����ԭ���������Ϊ
�� (3a+3b)mol ��[Vc-(9a+b)/3]mol �� Vc-(a+b)/3 mol ��(a+b)��189g
A. �٢ڢ� B. �٢� C. �ڢ� D. �ڢۢ�
���𰸡�A
����������Ӧ���е���Ԫ��ת��ΪFe(NO3)3����Ӧ��δ����ԭ���������Ϊ��(3a+3b)mol���(a+b)��189g��amolFeS��bmolFeOת��ΪFe(NO3)3��H2SO4��ʧȥ����(9a+b)mol�����ݵ�ʧ������Ŀ��ȿ�֪����NO(9a+b)/3mol����Ӧ��δ����ԭ���������Ϊ��[Vc-(9a+b)/3]mol����֮����Ӧ��δ����ԭ���������Ϊ�٢ڢܣ���ѡA��
�����͡���ѡ��
��������
25
����Ŀ����1���ڷ�Ӧʽ:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O�У���b=1��d=3����X�ķ���ʽΪ____________��
��2���������������ԭ��Ӧ�����ӷ�Ӧ����ʽ�����������ת�Ƶķ������Ŀ��___________
___CrI3+____Cl2+______����____K2CrO4+____KIO4+___KCl+______
���𰸡� NO 
��������(1)����ԭ���غ�ã�a=d=3��e=b=1��������ԭ���غ㣬��c=4��������ԭ���غ㣬��g=2������������N��Oԭ���غ㣬�Ƴ�X�Ļ�ѧʽΪNO���ʴ�Ϊ��NO��
(2)����CrI3��ϵ��Ϊ1������CrԪ���غ㣬K2CrO4��ϵ��Ϊ1������I�غ㣬KIO4��ϵ��Ϊ3�����ݻ��ϼ������غ㣬Cl2��ϵ��Ϊ![]() ������Cl�غ㣬KCl��ϵ��Ϊ27�����������غ㶨�ɣ���Ӧ������Ҫһ�ֺ���K��OԪ�ص����ʣ�Ӧ��ΪKOH�����������к���H2O������K�غ㣬KOH��ϵ��Ϊ32����H2O��ϵ��Ϊ16�������ƽΪ2CrI3+27Cl2+64KOH =2K2CrO4+6KIO4+54KCl+32H2O������ת�Ƶķ������Ŀ��ʾΪ��
������Cl�غ㣬KCl��ϵ��Ϊ27�����������غ㶨�ɣ���Ӧ������Ҫһ�ֺ���K��OԪ�ص����ʣ�Ӧ��ΪKOH�����������к���H2O������K�غ㣬KOH��ϵ��Ϊ32����H2O��ϵ��Ϊ16�������ƽΪ2CrI3+27Cl2+64KOH =2K2CrO4+6KIO4+54KCl+32H2O������ת�Ƶķ������Ŀ��ʾΪ��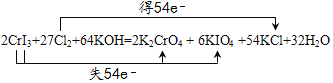 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��




