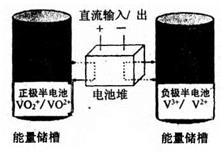
题目内容
按下图所示装置进行实验,并回答下列问题:
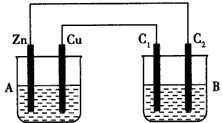

(1)判断装置的名称:A池为__________________,B池为________________________。
(2)铁极为_________极,电极反应式为________________________;铜极为________极,电极反应式为________________________ ;石墨棒C1为_______极,电极反应式为____________________________;石墨棒C2附近发生的实验现象为________,反应结束后,B池溶液的pH值________。(增大、减小、不变,忽略气体溶于水)
(3)当C2极析出224 mL气体(标准状况下),铁的质量________(增加或减少)__________g


(1)判断装置的名称:A池为__________________,B池为________________________。
(2)铁极为_________极,电极反应式为________________________;铜极为________极,电极反应式为________________________ ;石墨棒C1为_______极,电极反应式为____________________________;石墨棒C2附近发生的实验现象为________,反应结束后,B池溶液的pH值________。(增大、减小、不变,忽略气体溶于水)
(3)当C2极析出224 mL气体(标准状况下),铁的质量________(增加或减少)__________g
(1)原电池(1分) 电解池(1分)
(2)负极(1分) Fe-2e-=Fe2+ (2分)
正极(1分)Cu2++2e-="Cu" (2分)
阳极(1分) 2Cl--2e-=Cl2,(2分) 有气体生成,溶液变红(2分) 增大(1分)
(3)减少 0.56(各1分)
(2)负极(1分) Fe-2e-=Fe2+ (2分)
正极(1分)Cu2++2e-="Cu" (2分)
阳极(1分) 2Cl--2e-=Cl2,(2分) 有气体生成,溶液变红(2分) 增大(1分)
(3)减少 0.56(各1分)
试题分析:(1)A池可发生自发的氧化还原反应,为原电池。B池为电解池。(2)A池中铁比铜活泼,铁作负极,Fe-2e-=Fe2+ 铜作正极,Cu2++2e-=Cu,在B池中石墨棒C1与电源正极相连,作阳极,2Cl--2e-=Cl2,石墨棒C2作阴极,2H2O -2e-=H2 + 2OH- (3)C2产生H2224mL,物质的量为0.01mol,转移0.02mol电子,应反应0.01mol铁,质量为0.56g.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目
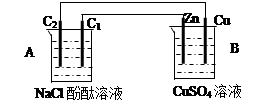
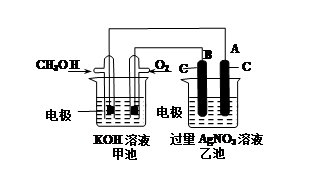
 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-