题目内容
9. 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O═NaN3+NaOH+NH3,3NaNH2+NaNO3═NaN3+3NaOH+NH3↑.
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O═NaN3+NaOH+NH3,3NaNH2+NaNO3═NaN3+3NaOH+NH3↑.回答下列问题:
(1)氮所在的周期中,电负性最大的元素是F,第一电离能最小的元素是Li.
(2)基态氮原子的L层轨道排布图为
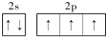 .
.(3)与N${\;}_{3}^{-}$互为等电子体的分子为N2O(写出一种).依据价层电子对互斥理论,NO${\;}_{3}^{-}$的空间构型为平面三角形.
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为离子晶体.叠氮化钠的水溶液呈碱性,用离子方程式表示其原因:N3-+H2O
 HN3+OH-;.
HN3+OH-;.(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是N2O分子间只存在范德华力,氨分子之间存在氢键,氢键作用较强.
(6)安全气囊的设计原理为6NaN3+Fe2O3 $\frac{\underline{\;撞击\;}}{\;}$3Na2O+2Fe+9N2↑.
①氮分子中σ键和π键数目之比为1:2.
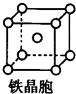
②铁晶体中存在的化学键类型为金属键.
③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为$\frac{112}{N{\;}_{A}•a{\;}^{3}}$g•cm-3(用含a、NA的表达式表示,其中NA为阿伏加德罗常数).
分析 (1)同周期随原子序数增大元素电负性增大、元素的第一电离能呈增大趋势;
(2)N原子2s轨道容纳2个电子,且自旋方向相反,2p能级3个轨道各容纳1个电子,且自旋方向相同;
(3)将1个N原子及1个单位负电荷用O原子替换,可得其等电子体;计算NO3-中N原子价层电子对数及孤电子对,确定其空间结构;
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)都含有活泼金属元素,属于离子化合物;叠氮化钠的水溶液中N3-离子发生水解,破坏水的电离平衡,溶液呈碱性;
(5)根据氨气分子之间存在氢键分析解答;
(6)①氮分子结构式为N≡N,三键含有1σ键、2个π键;
②铁晶体属于金属晶体,晶体中存在金属键;
③铁晶体为体心立方堆积,根据均摊法计算晶胞中含有2个Fe原子,结合摩尔质量计算晶胞质量,根据边长计算晶胞的体积,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)同周期随原子序数增大元素电负性增大、元素的第一电离能呈增大趋势,故氮所在的周期中,第二周期电负性最大的元素是F,第一电离能最小的元素是Li,
故答案为:F;Li;
(2)N原子2s轨道容纳2个电子,且自旋方向相反,2p能级3个轨道各容纳1个电子,且自旋方向相同,故基态氮原子的L层电子排布图为: ,
,
故答案为: ;
;
(3)将1个N原子及1个单位负电荷用O原子替换,可得其等电子体为N2O等,NO3-中N原子价层电子对数=3+$\frac{5+1-2×3}{2}$=3、N原子不含孤电子对,故其空间结构为平面三角形,
故答案为:N2O;平面三角形;
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)都含有活泼金属Na元素,由阴、阳离子构成,属于离子化合物;叠氮化钠的水溶液中N3-离子发生水解:N3-+H2O HN3+OH-,破坏水的电离平衡,溶液呈碱性,
HN3+OH-,破坏水的电离平衡,溶液呈碱性,
贵答案为:离子晶体;N3-+H2O HN3+OH-;
HN3+OH-;
(5)N2O分子间只存在范德华力,氨分子之间存在氢键,氢键作用较强,故氨气的沸点较高,
故答案为:N2O分子间只存在范德华力,氨分子之间存在氢键,氢键作用较强;
(6)①氮分子结构式为N≡N,三键含有1σ键、2个π键,氮分子中σ键和π键数目之比=1:2,
故答案为:1:2;
②铁晶体属于金属晶体,晶体中存在金属键,故答案为:金属键;
③铁晶体为体心立方堆积,由其晶胞结构可知,晶胞中Fe原子数目=1+8×$\frac{1}{8}$=2,故晶胞质量=2×$\frac{56}{N{\;}_{A}}$g,晶胞边长为acm,则晶胞的体积=(a cm)3=a3 cm3,故晶体密度=$\frac{2×\frac{56}{N{\;}_{A}}}{a{\;}^{3}}$=$\frac{112}{N{\;}_{A}•a{\;}^{3}}$g•cm-3,
故答案为:$\frac{112}{N{\;}_{A}•a{\;}^{3}}$g•cm-3.
点评 本题考查物质结构与性质,涉及元素周期律、核外电子排布、分子构型、等电子体、晶体类型、盐类水解、化学键、晶胞计算等,题目比较综合,需要学生全面掌握基础知识,侧重主干知识的考查,是常考知识点,注意利用均摊法进行晶胞的有关计算,难度中等.

 阅读快车系列答案
阅读快车系列答案| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)比较①与⑤的最高价氧化物对应的水化物,酸性强的是H2CO3(填化学式);能通过说明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(写反应的化学方程式).
(3)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因3NO2+H2O=2HNO3+NO(用化学方程式表示)
(5)比较③与⑥的氢化物,更稳定H2O(填化学式)
(6)③④两元素组成的化合物A2B2型电子式为:
 ,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.(7)⑨的单质与水反应所得离子化合物中阳离子半径<S2-(填“>”或“<”).
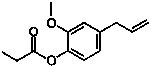 如图的有机物,则该有机物可发生的反应类型有( )
如图的有机物,则该有机物可发生的反应类型有( )①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦加聚.
| A. | ①②④⑤⑥ | B. | ①②③⑤⑦ | C. | ①②⑤⑥⑦ | D. | ①②④⑤⑦ |
| A. | 煤燃烧时将化学能全部转化为热能 | |
| B. | 原电池将化学能转化为电能 | |
| C. | 二次电池充电时将电能转化为化学能 | |
| D. | 镁条燃烧时将部分化学能转化为光能 |
| A. | 核内无中子的原子 | |
| B. | 外围电子排布为3s23p3 | |
| C. | 最外层电子数等于倒数第三层的电子数的原子 | |
| D. | N层上无电子,最外层的电子数等于电子层数的金属原子 |
| A. | 纯净的乙酸又称为冰醋酸 | B. | 乙酸能与金属钠反应放出氢气 | ||
| C. | 乙酸的酸性比碳酸强 | D. | 乙酸与乙醇不互溶 |
| A. | 氯水能导电,所以氯水属于电解质 | |
| B. | Al(OH)3既能溶于盐酸又能溶于NaOH溶液,属于两性氢氧化物 | |
| C. | 能电离产生H+的化合物一定是酸 | |
| D. | 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液 |
| A. | 氢原子光谱是原子的所有光谱中最简单的光谱之一 | |
| B. | “量子化”就是不连续的意思,微观粒子运动均有此特点 | |
| C. | 玻尔理论不但成功地解释了氢原子光谱,而且还推广到其他原子光谱 | |
| D. | 原子中的电子在具有确定半径的圆周轨道上像火车一样高速运转着 |
| A. | 100mL | B. | 200mL | C. | 300mL | D. | 400mL |