��Ŀ����
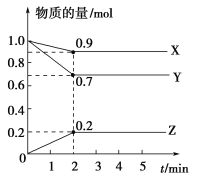
����Ŀ�����ױ����������Ȼ���������Ӧһ��ˮ��Ϲ��գ������л��Ȼ����յĸ���Ʒ�Ȼ���Ϊԭ���Ʊ�������ʵ���ȵ�ѭ�����ã�ԭ��Ϊ4HCl��g��+O2��g��2Cl2��g��+2H2O��g������HC1��O2�ֱ���5�����ʵ����ȣ���1��1 ��2��1 ��4��1 ��6��1 ��8��1��������ݻ��ɱ��������Ͷ��ʱ����Ӧ�¶ȶ�HClƽ��ת����Ӱ���������ͼ�� 
��ش��������⣺
��1�������жϸ÷�Ӧ�Ѿ��ﵽ��ѧƽ�����������ĸ����
A.�ܱ���������ѹǿ����
B.�ܱ������л��������ܶȲ���
C.v��HCl��=2v��Cl2��
D.�ܱ������К����������������
��2��d���߶�Ӧ��Ͷ�ϱ��������ֵ���������ѡ����ͬ�����л���ҵ��Ҫ��O2���͵��������Ȼ��������壬�ɿ���n��HCl����n��O2��=�Ʊ���
��3���÷�Ӧ��ƽ�ⳣ������ʽΪ ��
��4������b���߶�Ӧ��Ͷ�ϱȽ��з�Ӧ�����¶�Ϊ415�棬��Ӧ�ﵽƽ��ʱCl2���������Ϊ ��
��5�����������״�ȼ�ϵ�صĵ�������ڳ�Ϊ�ȵ���⣮�״�������һ����̼��������Ӧ���ɣ�����ΪCu2O/ZnO����
��֪��2CO��g��+O2��g���T2CO2��g����H=��566kJmol��1
CH3OH��g��+ ![]() O2��g���TCO2��g��+2H2��g����H=��182.9kJmol��1
O2��g���TCO2��g��+2H2��g����H=��182.9kJmol��1
�� CO��g��+2H2��g���TCH3OH��g����H= ��
�������ɵ�CH3OH�����ᡢ��������ȼ�ϵ�أ���ȼ�ϵ�صĸ�����ӦʽΪ
���𰸡�
��1��BD
��2��6��1��8��1
��3��![]()
��4��30.8%
��5����100.1KJ/mol��CH3OH+H2O��6e��=CO2+6H+
���������⣺��1��4HCl��g��+O2��g��2Cl2��g��+2H2O��g������Ӧ�����������С�ķ�Ӧ��
A���������ʵ��������仯�����ܱ���������ѹǿ���䣬˵����Ӧ�ﵽƽ��״̬����A��ȷ��
B�������������䣬������䣬�ܱ������л��������ܶ�ʼ�ղ��䣬��B����
C����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�Ϊ����Ӧ����֮�ȣ�v��HCl��=2v��Cl2������˵�����淴Ӧ������ͬ������˵����Ӧ�ﵽƽ��״̬����C����
D���ܱ������К������������������ƽ���־����D��ȷ��
���Դ��ǣ�BD��
��2.����������������ʱ��O2����Խ��HCl��ת����Խ���ɴ˿�ȷ��aΪ1��1��bΪ2��1��cΪ4��1��dΪ6��1��eΪ8��1���л���ҵ��Ҫ��O2���͵��������Ȼ��������壬�ɿ���n��HCl����n��O2��=8��1��
���Դ��ǣ�6��1��8��1��
��3.��4HCl��g��+O2��g��2Cl2��g��+2H2O��g������Ӧ��ƽ�ⳣ��K= ![]() ��
��
���Դ��ǣ� ![]() ��
��
��4.����ͼ�ɶ���Ͷ�ϱ�Ϊ2��1���¶�Ϊ415��ʱ��HCl��ת����Ϊ80%����Ͷ���HClΪ2 mol��O2Ϊ1 mol���ɴ˿ɽ�������ʽ��
4HCl | + | O2 | = | 2Cl2 | + | 2H2O | |
n����ʼ��/mol | 2 | 1 | 0 | 0 | |||
n��ת����/mol | 1.6 | 0.4 | 0.8 | 0.8 | |||
n��ƽ�㣩/mol | 0.4 | 0.6 | 0.8 | 0.8 |
����ƽ��������Cl2�����ʵ�������= ![]() ��100%=30.8%��
��100%=30.8%��
���Դ��ǣ�30.8%��
��5.����2CO��g��+O2��g���T2CO2��g����H=��566kJmol��1
��CH3OH��g��+ ![]() O2��g���TCO2��g��+2H2��g����H=��182.9kJmol��1
O2��g���TCO2��g��+2H2��g����H=��182.9kJmol��1
�� ���ݸ�˹���ɼ��㣨�٩��ڡ�2���� ![]() �õ��Ȼ�ѧ����ʽΪ��CO��g��+2H2��g���TCH3OH��g����H=��100.1KJ/mol��
�õ��Ȼ�ѧ����ʽΪ��CO��g��+2H2��g���TCH3OH��g����H=��100.1KJ/mol��
�������ɵ�CH3OH�����ᡢ��������ȼ�ϵ�أ���ȼ�ϵ�صĸ�����ӦΪ�״�ȼ��ʧ�������ɶ�����̼�������缫��ӦΪ��CH3OH+H2O��6e��=CO2+6H+ ��
���Դ��ǣ���100.1KJ/mol��CH3OH+H2O��6e��=CO2+6H+��
�����㾫����ͨ��������û�ѧƽ��״̬���жϺͻ�ѧƽ��ļ��㣬����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ���Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%�����Խ����⣮

 53���ò�ϵ�д�
53���ò�ϵ�д�