题目内容
(1)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg?mol-1.若阿伏加德罗常数用NA表示,则:①该气体的物质的量为______mol.
②该气体所含原子总数为______个.
③该气体在标准状况下的体积为______L.
④该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______.
(2)利用“化学计量在实验中的应用”的相关知识进行填空
①含有6.02×1023个氧原子的H2SO4的物质的量是______?mol
②与标准状况下VLCO2所含氧原子数目相同的水的质量是______(用分式表示)
③在一定的温度和压强下,1体积X2 (g)跟3体积Y2 (g)化合生成2体积化合物,则该化合物的化学式是______
④三种正盐的混合溶液中含有0.2mol Na+、0.25mol Mg2+、0.4mol Cl-、SO42-,则
n(SO42-) 为______ mol
(3)假如12C相对原子质量为24,以0.024kg所含12C原子数为阿伏加德罗常数,下列数值肯定不变的是______.
A.氧气的溶解度
B.气体摩尔体积
C.一定质量的气体体积
D.阿伏加德罗常数
E.O2相对分子质量
F.跟2mLH2 相化合的O2的质量、物质的量.
【答案】分析:(1)根据n=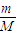 =
=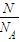 =
=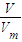 结合分子组成计算相关物理量,根据w=
结合分子组成计算相关物理量,根据w= 计算质量分数;
计算质量分数;
(2)①根据n=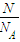 计算;
计算;
②n=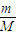 =
=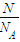 =
=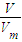 计算;
计算;
③根据质量守恒定律和阿伏加德罗定律计算;
④根据溶液的电中性原则计算;
(3)相对原子质量和阿伏加德罗常数改变时,一个原子的实际质量不变,溶解度不变.
解答:解:(1)①n=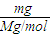 =
=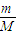 mol,故答案为:
mol,故答案为: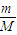 ;
;
②由于该气体为双原子分子,则原子数为:N=nNA=2×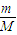 ×NA=
×NA=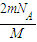 ,故答案为:
,故答案为: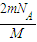 ;
;
③V=nVm=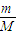 mol×22.4L/mol=
mol×22.4L/mol=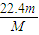 L,故答案为:
L,故答案为: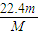 ;
;
④1L水的质量为1000g,该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为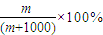 ,
,
故答案为: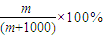 ;
;
(2)①n(O)=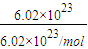 =1mol,n(H2SO4)=
=1mol,n(H2SO4)= n(O)=0.25mol,故答案为:0.25;
n(O)=0.25mol,故答案为:0.25;
②n(CO2)=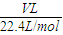 =
=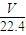 mol,
mol,
n(O)=2n(CO2)=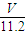 mol,
mol,
n(H2O)=n(O)=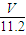 mol,
mol,
m(H2O)=nM=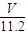 mol×18g/mol=
mol×18g/mol=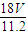 g,故答案为:
g,故答案为: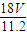 g;
g;
③在相同的温度和压强下,气体的体积之比等于物质的量之比,1体积X2 (g)跟3体积Y2 (g)化合生成2体积化合物,根据质量守恒定律和阿伏加德罗定律,设生成物为C,
则有:X2+3Y2=2C,生成物的化学式应为XY3,故答案为:XY3;
④根据溶液的电中性原则,溶液中存在:n(Na+)+2n(Mg2+)=n(Cl-)+2n(SO42-),
则n(SO42-)=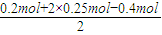 =0.15mol,故答案为:0.15;
=0.15mol,故答案为:0.15;
(3)假如12C相对原子质量为24,以0.024kg所含12C原子数为阿伏加德罗常数,变化的值有气体摩尔体积、阿伏加德罗常数、相对分子质量以及物质的量等物理量,而溶解度100g水中溶解溶质的质量,与相对原子质量或阿伏加德罗常数无关,一定质量的气体的分子个数不变,则体积不变,
故答案为:AC.
点评:本题较为综合,题目难度中等,注意有关物质的量的计算公式的运用,本题易错点为(3)题,注意理解阿伏加德罗常数.
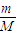 =
=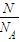 =
=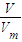 结合分子组成计算相关物理量,根据w=
结合分子组成计算相关物理量,根据w= 计算质量分数;
计算质量分数;(2)①根据n=
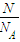 计算;
计算;②n=
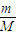 =
=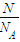 =
=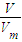 计算;
计算;③根据质量守恒定律和阿伏加德罗定律计算;
④根据溶液的电中性原则计算;
(3)相对原子质量和阿伏加德罗常数改变时,一个原子的实际质量不变,溶解度不变.
解答:解:(1)①n=
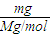 =
=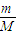 mol,故答案为:
mol,故答案为: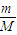 ;
;②由于该气体为双原子分子,则原子数为:N=nNA=2×
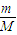 ×NA=
×NA=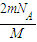 ,故答案为:
,故答案为: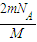 ;
;③V=nVm=
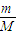 mol×22.4L/mol=
mol×22.4L/mol=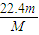 L,故答案为:
L,故答案为: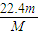 ;
;④1L水的质量为1000g,该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为
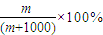 ,
,故答案为:
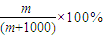 ;
;(2)①n(O)=
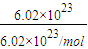 =1mol,n(H2SO4)=
=1mol,n(H2SO4)= n(O)=0.25mol,故答案为:0.25;
n(O)=0.25mol,故答案为:0.25;②n(CO2)=
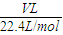 =
=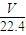 mol,
mol,n(O)=2n(CO2)=
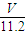 mol,
mol,n(H2O)=n(O)=
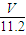 mol,
mol,m(H2O)=nM=
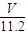 mol×18g/mol=
mol×18g/mol=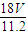 g,故答案为:
g,故答案为: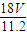 g;
g;③在相同的温度和压强下,气体的体积之比等于物质的量之比,1体积X2 (g)跟3体积Y2 (g)化合生成2体积化合物,根据质量守恒定律和阿伏加德罗定律,设生成物为C,
则有:X2+3Y2=2C,生成物的化学式应为XY3,故答案为:XY3;
④根据溶液的电中性原则,溶液中存在:n(Na+)+2n(Mg2+)=n(Cl-)+2n(SO42-),
则n(SO42-)=
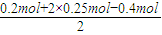 =0.15mol,故答案为:0.15;
=0.15mol,故答案为:0.15;(3)假如12C相对原子质量为24,以0.024kg所含12C原子数为阿伏加德罗常数,变化的值有气体摩尔体积、阿伏加德罗常数、相对分子质量以及物质的量等物理量,而溶解度100g水中溶解溶质的质量,与相对原子质量或阿伏加德罗常数无关,一定质量的气体的分子个数不变,则体积不变,
故答案为:AC.
点评:本题较为综合,题目难度中等,注意有关物质的量的计算公式的运用,本题易错点为(3)题,注意理解阿伏加德罗常数.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目