题目内容
七水硫酸镁(MgSO4?7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度 / ℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
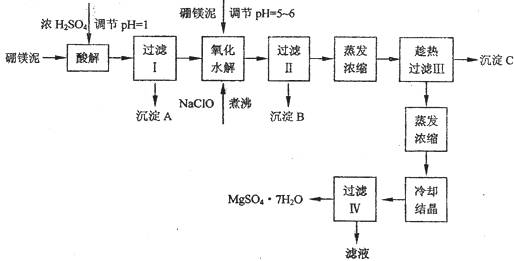
硼镁泥制取七水硫酸镁的工艺流程如下:
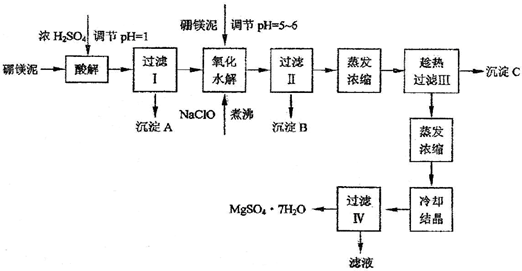
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的是_ 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤II需趁热过滤的理由是
(1)Mn2++ClO-+H2O=MnO2↓+2H++Cl-
促进Al3+、Fe3+水解及Mn2+氧化成MnO2
(2)Fe(OH)3 Al(OH)3
(3)取过滤II后的滤液1~2 ml于试管中,加入少量KSCN溶液,如果溶液不显红色,
证明滤液中无Fe3+
(4)CaSO4?2H2O或CaSO4
以防MgSO4在温度低时结晶析出。

利用化工厂生产硼砂的废渣--硼镁泥可制取七水硫酸镁(MgSO4?7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |

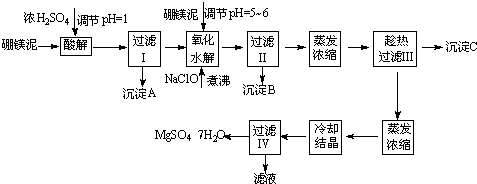
根据以上流程图并参考pH数据和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是______(选填序号).
a.被钝化 b.被氧化 c.被溶解
(2)往过滤Ⅰ得到的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液可将溶液中的Mn2+氧化成MnO2,该反应的离子反应方程式为______.加热煮沸的目的是_______.
(3)沉淀B中除MnO2外还含有______(填化学式)等物质.
(4)沉淀C的化学式是______;产生沉淀C的操作需趁热进行的原因是______;洗涤沉淀需要的玻璃仪器有:烧杯、______;若用乙醇代替水作洗涤剂洗涤沉淀C,原因是______.
(5)过滤出MgSO4?7H2O晶体的滤液中含有的金属阳离子有______,生产中对该滤液的处理方法是______;检验滤液是否含有SO42-操作是______.
(12分)七水硫酸镁(MgSO4?7H2O)为白色细小四角柱状结晶,无臭,味苦,在干燥空气中易风化,易溶于水,缓溶于甘油,微溶于乙醇,热至68℃以上熔化。在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣――硼镁泥可制取七水硫酸镁。
表1 硼镁泥的主要化学成分
成分 | MgO | SiO2 | Fe2O3 | CaO | B2O3 | Al2O3 | MnO | CO2 |
质量分数% | 25-38 | 18-25 | 6-15 | 1-3 | 1-2 | 1-2 | 1-2 | 15-20 |
表2 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
硼镁泥制取七水硫酸镁的工艺流程如下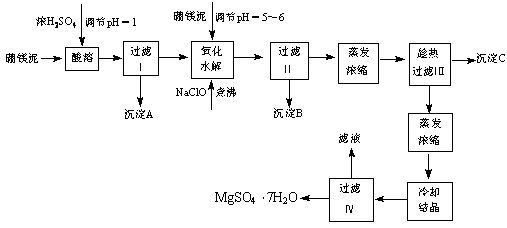
根据以上流程图并参考表格数据,试回答下列问题:
⑴ 硼镁泥是硼镁矿生产硼砂(Na2B4O7?10H2O)时的废渣。将硼镁矿(2MgO?B2O)锻烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。此反应为熵减小反应, 试写出反应方程式: 。
⑵ 沉淀A中除二氧化硅外,还含有硼酸,硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式 。
⑶ CaSO4的溶解度随温度升高变化不明显,在得到沉淀C时,对蒸发浓缩后的溶液却要进行趁热过滤,原因是 。
⑷ 经对沉淀B进行分析,发现其中含有二氧化锰,用方程式解释原因: 。
⑸ 用正三辛胺(TOA)做萃取剂,磺化煤油做稀释剂,通过有机萃取也可以用来除去硫酸镁浸出液中的铁。其主要反应如下:
Fe2++H2O=Fe(OH)2++H+ ⑴
Fe(OH)2++SO42-=Fe(OH)SO4 ⑵
2R3N+H2SO4=(R3NH)2SO4 ⑶
Fe(OH)SO4+(R3NH)2SO4=Fe(OH)SO4?(R3NH)2SO4 ⑷
试问:浸出液初始pH须加H2SO4调至0.9左右,pH>1.5时不利于萃取。试给出须加H2SO4的两个理由
![]() 。
。
![]() pH<0.5亦不利于萃取,给出其主要原因
pH<0.5亦不利于萃取,给出其主要原因 ![]() 。
。